
Information
från Läkemedelsverket
ÅRGÅNG 16 • NUMMER 5 • OKTOBER 2005
Behandling och profylax av
influensa ..............................................9
De tidigare rekommendationerna för behandling av influensa
har nu uppdaterats. Vid ett expertmöte, som Läkemedelsverket
anordnade tillsammans med Referensgruppen för Antiviral
terapi (RAV), konstaterades att årlig vaccination av medicinska
riskgrupper är den viktigaste åtgärden för att begränsa de medi-
cinska konsekvenserna av influensa. De nya rekommendatio-
nerna har även kompletterats med ett avsnitt om fågelinfluensa
och influensapandemi.
Farmakologisk behandling
av depression hos barn och
ungdomar ..........................................23
Behandlingen av barn och ungdomar med depression är myck-
et omdiskuterad. Inga antidepressiva läkemedel är godkända
för behandling av depression hos barn och ungdomar i Europa,
men ibland bedöms ändå farmakologisk behandling vara nöd-
vändig. Rapporter om biverkningar, såsom självmordstankar
och utsättningsproblem, har gjort att professionen efterlyst en
uppdatering av kunskapsläget.
Erytromycin bör undvikas i tidig graviditet ...... 3
Nya läkemedel ...........................................44
Nya data tyder på att användningen av erytromycin under tidig
Aftasol (amlexanox)
graviditet innebär en ökad risk för hjärtkärlmissbildning.
Aclasta (zoledronsyra)
Ciloxan (ciprofloxacin)
Paracetamol kan öka INR vid
Hexvix (hexaminolevulinat)
Ritalin (metylfenidathydroklorid)
warfarinbehandling ......................................4
Velcade (bortezomib)
Kombinationen är inte kontraindicerad, men vid underhålls-
behandling med paracetamol till warfarinbehandlade patienter
Nya veterinärmedicinska läkemedel ..........57
bör en intensivare monitorering av INR göras. En ny studie har
Atopica Vet (ciklosporin)
nu stärkt dokumentationen för detta.
Equilis StrepE (vaccin mot Streptococcus equi)
Hexavac dras in tillfälligt ..............................5
LFN informerar ...........................................61
EMEA har beslutat att som en försiktighetsåtgärd tillfälligt
Fortsatt granskning av blodtrycksläkemedel
dra tillbaka försäljningstillståndet för kombinationsvaccinet
Utredningen om blodtrycksläkemedlens subvention går vidare
Hexavac på grund av tveksamhet avseende det långvariga
in i en ny fas.
vaccinskyddet mot hepatit B.
Beviljad subvention för Ritalin
Ritalin, som används vid behandling av ADHD, ska ingå i
Spelberoende - en rapporterad biverkan vid
läkemedelsförmånerna.
parkinsonbehandling .................................37
Beviljad ansökan för Emselex
En nyligen publicerad artikel beskriver ett plötsligt insättande
Emselex, som används vid behandling av överaktiv blåsa, ska
spelmissbruk hos parkinsonpatienter som behandlats med
ingå i läkemedelsförmånerna.
dopaminagonister.
Begränsad subvention för Elidel
Eksemläkemedlet Elidel ska ingå i förmånerna med vissa be-
gränsningar.
Läkemedelsverkets webbplats – www.mpa.se
1
Information från Läkemedelsverket NN:2004
link to page 3 link to page 4 link to page 4 link to page 4 link to page 5 link to page 5 link to page 5 link to page 6 link to page 6 link to page 7 link to page 8 link to page 8 link to page 8 link to page 9 link to page 9 link to page 9 link to page 23 link to page 23 link to page 23 link to page 23 link to page 29 link to page 29 link to page 29 link to page 29 link to page 29 link to page 29 link to page 29 link to page 29 link to page 33 link to page 33 link to page 35 link to page 35 link to page 37 link to page 37 link to page 37 link to page 38 link to page 44 link to page 44 link to page 47 link to page 48 link to page 50 link to page 51 link to page 54 link to page 57 link to page 57 link to page 59 link to page 61 link to page 61 link to page 61 link to page 62 link to page 62 link to page 63 link to page 63
Innehåll
Observanda
Biverkningsnytt
Erytromycin bör undvikas under tidig graviditet .... 3
Spelberoende - en rapporterad biverkan vid
Paracetamol kan öka INR vid warfarinbehandling—
Parkinsonbehandling ........................................... 37
en dåligt (?) känd interaktion? ............................... 4
Biverkningsarbetet år 2004 ................................. 38
Ketamin narkotikaklassat ....................................... 4
Läkemedelsmonografier
Kombinationsvaccinet Hexavac dras in tillfälligt
Aclasta (zoledronsyra) ........................................ 44
– Nationella aspekter ............................................. 5
Aftasol (amlexanox) ............................................ 47
EMEA avslutar säkerhetsgenomgång av coxiber .... 5
Ciloxan (ciprofloxacin) ....................................... 48
Påminnelse om att varningstriangeln försvinner .... 6
Hexvix (hexaminolevulinat) ............................... 50
Ordinera extempore via e-recept nu möjligt .......... 6
Ritalin (metylfenidathydroklorid) ........................ 51
Fosamax och utbytbarhet ...................................... 7
Velcade (bortezomib) ......................................... 54
Läkemedelsverket och Svenska Farmakopékommittén
inbjuder till Farmakopédag .................................. 8
Veterinärmedicinska läkemedel
Behandling och profylax av influensa med
Atopica vet. (ciklosporin) .................................... 57
antivirala medel
Equilis StrepE (vaccin mot Streptococcus equi) ... 59
— Behandlingsrekommendation ......................... 9
Läkemedelsförmånsnämnden informerar
Farmakologisk behandling av depression
Fortsatt granskning av blodtrycksläkemedel ........ 61
hos barn och ungdomar – en uppdatering av
kunskapsläget
LFN beviljar subvention för Ritalin ..................... 61
– Behandlingsrekommendation ........................ 23
LFN beviljar ansökan för Emselex ....................... 62
Begränsad subvention för Elidel .......................... 62
Farmakologisk behandling av depression
hos barn och ungdomar – en uppdatering av
Snabbare nyheter med LFN:s nyhetstjänst ........... 63
kunskapsläget
Snabbguide till LFN:s beslut ............................... 63
– Bakgrundsdokumentation ............................. 29
Biverkningsblanketter
Uppdatering av SBU-rapport ”Effekten av
Rapportering av läkemedelsbiverkningar .............. 64
behandling med farmaka vid depression hos barn och
ungdomar” ......................................................... 29
Fluoxetin vid egentlig depression hos barn och
ungdomar ........................................................... 33
Självmordsrelaterat beteende vid antidepressiv
farmakologisk behandling av barn och ungdomar .... 35
Information från Läkemedelsverket
Redaktion:
Box 26, 751 03 Uppsala
Björn Beermann, Christina Brandt,
Telefon 018-17 46 00
Jowan Resul och Kristina Bergström.
Telefax 018-54 85 66
Ytterligare exemplar kan rekvireras från:
Ansvarig utgivare:
Enheten för läkemedelsinformation och
Gunnar Alvan
läkemedel i användning
ISSN 1101-7104
AB Danagårds Grafiska 2005
2
Information från Läkemedelsverket 5:2005
Erytromycin bör undvikas under tidig graviditet
Erytromycin är ett antibiotikum, som har funnits och
tills haft följande lydelse: ’Inga kända risker vid an-
använts i Sverige sedan 1950-talet och f.n. finns två
vändning under graviditet’. Läkemedelsverket anser
produkter på marknaden: Ery-Max (AstraZeneca) och
att den nya studien tillsammans med en möjlig me-
Abboticin (Abbott). En ny studie från det svenska med-
kanistisk förklaring ger belägg för att det kan finnas
icinska födelseregistret tyder på att användning av er-
en ökad risk vid användning under tidig graviditet
ytromycin under tidig graviditet innebär en ökad risk
och att detta utgör skäl för att, om det inte är absolut
för hjärtkärlmissbildning (1). Resultatet bör tolkas
nödvändigt, undvika användning av erytromycin då.
försiktigt, eftersom påverkan av samverkande faktorer
Detta innebär att samma grad av försiktighet re-
inte helt kan uteslutas genom studiens design.
kommenderas för erytromycin, som redan gäller för
andra makrolider, där djurdata tyder på risk. Pro-
Bakgrund
duktinformationen för läkemedel som innehåller er-
ytromycin kommer att uppdateras snarast.
Under perioden 1995 till 2002 inkluderades totalt
Då kunskapen om fostereffekter är begränsad för
677 028 barn i det medicinska födelseregistret. Er-
de flesta antibiotika, måste en noggrann risk/nytta
ytromycin hade använts av 1 844 mödrar under tidig
värdering göras inför behandling i tidig graviditet,
graviditet. Av dessa mödrar föddes 31 barn med en
där behovet av behandling av den gravida kvinnan
hjärtkärlmissbildning mot förväntat 17 (där det för-
vägs mot risken för fosterpåverkan.
väntade värdet beräknats utifrån den totala förekom-
Frågan om antibiotikabehandling under graviditet
sten av hjärtkärlmissbildning bland alla födda barn).
kommer att bli föremål för ett expertmöte på Läke-
Eftersom det inte kan uteslutas att en ökad före-
medelsverket under hösten 2005.
komst av hjärtkärlmissbildning skulle kunna förklaras
av den bakomliggande infektionssjukdom, som var
Referenser
Källén BA, Otterblad-Olausson P, Danielsson B: Is erythro-
anledning till behandling med erytromycin, gjordes
mycin therapy teratogenic in humans? Reprod Toxicol
motsvarande analys på mödrar, som behandlats med
2005;20(2):209–214.
V-penicillin i tidig graviditet (9 110 barn). Av dessa
Webster R, Leishman D, Walker D. Towards a drug concentration
mödrar föddes 84 barn med hjärtkärlmissbildning
effect for QT prolongation and torsades de pointes. Current
Opinion Drug Discovery Develop 2002;5:116–26.
mot förväntat 85, dvs. penicillinbehandlingen var
Volberg WA, Koci BJ, Su W, et al. Blockade of human car-
inte förenad med ökad risk för hjärtkärlmissbildning.
diac potassium channel human ether a go-go-related gene
(HERG) by macrolide antibiotics. J Pharmacol Exp Ther
Finns någon tänkbar orsaksförklaring?
2002;302:320–7.
Nya studier har visat att erytromycin kan blockera
Stanat SJ, Carlton CG, Crumb WJ Jr, Agrawal KC, Clarkson CW.
Characterization of the inhibitory effects of erythromycin and
en specifik kaliumkanal (uttryckt av hERG – human
clarithromycin on the HERG potassium channel. Mol Cell
ether a-go-go related gene), som är av stor betydelse
Biochem 2003;254:1–7.
för reglering av hjärtats rytm (2–4). Både i experi-
Milberg P, Eckardt L, Bruns HJ, et al. Divergent proarrhythmic
mentella modeller (5–6) och i en stor klinisk studie
potential of macrolide antibiotics despite similar QT prolong-
ation: fast phase 3 repolarization prevents early after depo-
(7) har denna egenskap hos erytromycin visat sig
larizations and torsades de pointes. J Pharmacol Exp Ther
kunna ge upphov till ökad risk för ventrikulär arytmi
2002;303:218–25.
hos vuxna.
Hondeghem LM, Hoffmann P. Blinded test in isolated female
Djurstudier har visat att läkemedel som blockerar
rabbit heart reliably identifies action potential prolongation
and proarrhythmic drug importance of triangulation, rever-
hERG-kanalen ger upphov till hjärtkärlmissbildning-
se use dependence, and instability. J Cardiovasc Pharmacol
ar, sannolikt som en följd av arytmi hos det omogna
2003;41:1–3.
embryohjärtat under en period då hjärtkärlutveck-
Ray el at.Oral Erythromycin and the Risk of Sudden Death from
lingen pågår (8–10). Liknande effekter har setts i
Cardiac Causes. N Engl J Med 2004;351:1089–96).
Sköld AC, Wellfelt K, Danielsson BR. Stage-specific skeletal and
djurstudier med andra makrolider än erytromycin,
visceral defects of the I(Kr)-blocker almokalant: further evi-
men humandata saknas.
dence for teratogenicity via a hypoxia-related mechanism. Te-
Det finns få data hos människa avseende expone-
ratology 2001;64: 292–300.
ring för erytromycin senare i graviditeten (efter gra-
Danielsson BR, Sköld AC, Azarbayjani F. Class III antiarhythmics
and phenytoin: teratogenicity due to embryonic cardiac dysr-
viditetsvecka 12–13), men den troliga mekanismen
hythmia and reoxygenation damage. Curr Pharm Des 2001;7:
talar för att risken för hjärtpåverkan då är mindre.
787–802.
Sköld AC, Danielsson C, Linder B, Danielsson BR. Teratogenicity
Läkemedelsverkets bedömning
of IKr-blocker cisapride: relation to embryonic cardiac arr-
hythmia. Reprod Toxicol 2002;16:333–42.
Erytromycin har funnits tillgängligt mycket länge
och sannolikt använts av många gravida kvinnor. Pro-
duktresumé och FASS-text för erytromycin har hit-
Information från Läkemedelsverket 5:2005 3
Observanda
Paracetamol kan öka INR vid warfarinbehandling — en dåligt (?) känd interaktion?
Paracetamol kan öka INR vid warfarinbehandling—
en dåligt (?) känd interaktion?
Läkemedelsverket har nyligen fått information från
(INR 2–3) inkluderades. Patienterna randomisera-
sjukvården om att man inte kände till att paraceta-
des till placebo två veckor, wash-out under minst två
mol, basläkemedlet för smärtbehandling av patienter
veckor, 1 g paracetamol × 4 två veckor alternativt be-
som står på warfarin, interagerar med warfarin. Inter-
handling i motsatt ordning.
aktionen beskrevs i Information från Läkemedelsver-
Under paracetamolperioden hade INR ökat redan
ket år 2000 (1) och på verkets hemsida. Slutsatsen i
efter fyra dygn 0,6 + 0,6 (p<0,001) och ökningen
artikeln var att
bestod under tvåveckorsperioden medan INR inte
”Paracetamol i underhållsbehandling i dos minst
förändrades under placeboperioden Maximal INR
1,5 g per dag i minst fem dagar kan ge ökad anti-
var 3,47 + 0,75 respektive 2,61 + 0,40 (p<0,001)
koagulation hos warfarinbehandlade patienter. Kom-
och INR var >3 hos nio respektive tre patienter under
binationen är inte kontraindicerad men en intensivare
de två perioderna (p<0,03). På grund av INR >3,5
monitorering av INR bör ske vid in- och utsättning
vid två konsekutiva prov avbröts behandlingen med
av underhållsbehandling med paracetamol till dessa
paracetamol hos tre patienter men hos ingen under
patienter.”
placebobehandlingen.
Interaktionen framhålls i produktresuméerna och
Den nya studien stärker ytterligare behovet av tä-
bipacksedlarna för såväl warfarin som för paraceta-
tare monitorering av INR vid behandling med höga
molpreparat.
doser paracetamol under mer än tre dagar av warfa-
Troligen är interaktionen av farmakodynamisk
rinbehandlade patienter.
(2) och inte av farmakokinetisk (3) natur. Det har
Litteratur
visats att den toxiska paracetamolmetaboliten N-ace-
1. Dahlqvist R. Paracetamol interagerar med warfarin. Informa-
tion från Läkemedelsverket 2000;6:3.
tyl-para-bensoquininimin hämmar enzymer i K-vi-
2. Kwan D, Bartle WR, Walker SE. The effects of acetaminophen
tamincykeln, framför allt vitamin-K-beroende-gam-
on pharmacokinetics and pharmacodynamics of warfarin. Clin
makarboxylas (3).
Pharmacol, 1999;39:68–75.
Dokumentationen har nu stärkts ytterligare då
3. Thijssen HH, Soute BA, Vervoort LM, et al. Paracetamol
(acetaminophen) warfarin interaction: NAPQI, the toxic me-
dokumentationen fram till nyligen utgjorts av obser-
tabolite of paracetamol, is an inhibitor of enzymes in the vita-
vationsstudier, fallbeskrivningar och studier på friska
min K cycle. Thromb Haemost, 2004;92:797–802.
försökspersoner. En ny dubbelblind, cross-over pa-
4. Mahe I, Bertrand N, Drouet L, et al. Paracetamol: a haemor-
racetamol-placebostudie (4) har publicerats i vilken
rhagic risk factor in patients on warfarin. Br J Clin Pharmacol,
2005;59:371–4.
elva välkontrollerade warfarinbehandlade patienter
Ketamin narkotikaklassat
Sedan den 1 juli 2005 är läkemedelssubstansen keta-
Regeringen har genom förordning föreskrivit om
min klassificerat som narkotika. Orsaken är bl.a. ett
ändring i förordningen (1992:1554) om kontroll
ökat antal signaler om missbruk. Narkotikaklassning-
av narkotika att substansen ketamin skall införas un-
en innebär speciella restriktioner vad gäller bl.a. im-
der rubriken ”smärtstillande medel”. Innebörden av
port och export av substansen.
förordningen är således att ketamin klassificeras som
narkotika.
Ketamin används främst för induktion och underhåll
Förordningen trädde i kraft den 1 juli. Ketamin
av anestesi vid diagnostiska och kirurgiska ingrepp.
skall tillhöra svensk narkotikaförteckning IV och som
Ketamin bör endast administreras under uppsikt och
en följd därav kommer import- och exportcertifikat
i närvaro av anestesiolog. Någon förskrivning till pa-
krävas för substansen. Föreskriften om förteckningar
tient sker ej.
över narkotika (LVFS 1997:12, omtryckt genom
Antalet signaler om missbruk av substansen keta-
LVFS 2000:7 och därefter ändrad genom LVFS
min har ökat kraftigt under framförallt våren 2005.
2001:4, 2002:4 samt 2004:2) har genom LVFS
Ketamin är idag klassificerat som narkotika i bl.a. Bel-
2005:5 kompletterats med ketamin.
gien, Frankrike, Irland, Grekland och USA.
4
Information från Läkemedelsverket 5:2005
Observanda
Kombinationsvaccinet Hexavac dras in tillfälligt - Nationella aspekter
Kombinationsvaccinet Hexavac dras in tillfälligt –
Nationella aspekter
Hexavac är ett kombinationsvaccin som ges mot sex
inte kunnat identifieras, men tillverkaren har inlett en
olika sjukdomar: difteri, stelkramp, kikhosta, polio,
översyn av tillverkningsprocessen för hepatit B-kom-
Haemophilus influenzae b-infektion och hepatit B.
ponenten i vaccinet. I avvaktan på att detta sker och
Efter beslut i den europeiska läkemedelsnämnden
ytterligare studier genomförs, dras produkten under
(CHMP) kommer vaccinet, som en försiktighetsåt-
en tid tillbaka från marknaden i hela EU.
gärd, att tillfälligt dras tillbaka, eftersom otillräckligt
Ett liknande kombinationsvaccin, Infanrix hexa,
långtidsskydd mot hepatit B har konstaterats i vissa
godkändes i EU år 2000 och används i Sverige på
fall. Beslutet beror däremot ej på oro för biverkning-
motsvarande sätt som Hexavac. Detta vaccin finns
ar. Någon misstanke om försämrad skyddseffekt mot
fortfarande tillgängligt. Likaså finns de pentavalenta
de övriga sjukdomarna finns inte.
vaccinerna tillgängliga och kan användas. Om behov
Vaccinet, som tillverkas av Sanofi Pasteur MSD,
av skydd mot hepatit B föreligger kan dessa kombi-
har varit godkänt i hela EU sedan år 2000. Det har
neras med vaccin, som enbart innehåller hepatit B-
använts i begränsad omfattning i Sverige och har gi-
komponenten.
vits till barn som bedömts löpa ökad risk att smittas
Risken för hepatit B-smitta i Europa är i allmänhet
med hepatit B.
liten och några sjukdomsfall som tecken på utebliven
De flesta barn vaccineras i Sverige med kombina-
effekt av Hexavac har inte inträffat. Eftersom det är
tionsvacciner som innehåller komponenter som skyd-
det långsiktiga skyddet mot hepatit B som bedömts
dar mot fem olika sjukdomar (s.k. pentavalenta vac-
vara osäkert finns det ingen omedelbar risk för barn
ciner, Pentavac, Infanrix-Polio + Hib).
som vaccinerats med Hexavac. Frågorna beträffande
Vaccin mot hepatit B ingår inte i dessa men de ger
långtidsskyddet och eventuellt behov av en förnyel-
skydd mot övriga fem sjukdomar som nämns ovan.
sedos kommer emellertid att följas upp i ett program
Orsaken till indragningen är att man i nya kli-
som ska utarbetas av tillverkaren.
niska studier upptäckt att hepatit B-komponenten
De barn som hunnit påbörja men ej avslutat vac-
i Hexavac inte alltid ger upphov till det förväntade
cinationsserien med tre doser bör erbjudas alternativt
immunsvaret. Därigenom kan vaccinets skyddseffekt
vaccin när återstående dos/doser skall ges.
på lång sikt bli otillräcklig. Någon säker förklaring har
Mer information finns på vår webbplats, www.mpa.se.
EMEA avslutar säkerhetsgenomgång av coxiber
Läkemedelsverket har vid upprepade tillfällen under
För alla coxiber införs varning för överkänslighetsre-
det senaste året publicerat ny information om biverk-
aktioner och sällsynta men allvarliga hudreaktioner.
ningar av coxiber. En genomgång av säkerheten har
Vanligen inträffar dessa reaktioner under den första
nu avslutats i europasamarbetet.
behandlingsmånaden. Risken bedöms vara ökad för
Perifer arteriell kärlsjukdom har nu tillkommit som
patienter med tidigare läkemedelsallergi.
kontraindikation (dvs. läkemedlet skall ej användas)
Den tidigare påbörjade utvärderingen av speciellt
vid behandling med coxiber. Sedan tidigare är hjärt/
kardiovaskulär säkerhet för vissa äldre NSAID-läke-
kärlsjukdomar såsom angina pectoris (kärlkramp),
medel (smärtstillande och antiinflammatoriska läke-
hjärtinfarkt, hjärtsvikt (NYHA-klass II-IV) samt
medel) fortsätter.
stroke kontraindicerade.
Information från Läkemedelsverket 5:2005 5
Observanda
Påminnelse om att varningstriangeln försvinner
Påminnelse om att varningstriangeln försvinner
Enligt vad Läkemedelsverket tidigare har informerat
information i denna bipacksedel för vägledning. Dis-
avvecklas varningstriangeln som har funnits på vissa
kutera med din läkare eller apotekspersonal om du är
läkemedelsförpackningar. Bipacksedlarna för de flesta
osäker.”
läkemedel kommer att tillföras en text som betonar
I princip alla läkemedel kommer att förses med
vikten av att patienten inför bilkörning själv bedömer
varningstexten. Undantagna är vitaminer, mineraler
sin körförmåga, oavsett vilket läkemedel han eller hon
och de flesta läkemedel avsedda för lokalbehand-
använder. Ändringen i märkningsföreskriften (LVFS
ling – en fullständig lista över undantagna preparat
1994:11, ändrad och omtryckt genom LVFS 1995:11)
finns tillgänglig på Läkemedelsverkets webbplats,
började gälla från och med 1 juli 2005. Under en över-
www.mpa.se.
gångsperiod kan varningstriangeln existera parallellt
Liksom tidigare är det viktigt att förskrivare infor-
med den varnande texten i bipacksedeln.
merar sina patienter om vikten av att läsa bipackse-
deln inför användning av läkemedlet.
Många trafikfarliga läkemedel har haft en varnings-
märkning i form av en röd varningstriangel på läke-
Exempel på situationer då
medelsförpackningen. Människor reagerar emellertid
reaktionsförmågan är nedsatt
mycket individuellt på läkemedel. Vissa klarar att köra
Generellt gäller att alla individer reagerar olika på lä-
bil utan problem fastän de använder ett läkemedel
kemedel, men risken för att reaktionsförmågan på-
med varningstriangel, medan andra kan få körförmå-
verkas negativt är störst i början av en ny eller ändrad
gan nedsatt av ett läkemedel utan varningstriangel.
läkemedelsbehandling. Dåsighet, trötthet eller yrsel,
Problemet med denna märkning har varit att de som
påverkad syn eller hörsel, koncentrationssvårigheter,
använt ett läkemedel utan varningstriangel invaggats
minnesstörningar, stress eller hyperaktivitet är exem-
i en falsk trygghet då även dessa läkemedel kan på-
pel på faktorer som kan försämra körförmågan.
verka körförmågan. Därtill är enligt svensk lag varje
individ själv ansvarig för att bedöma om han eller hon
Övergångsperiod mellan 1 juli 2005
är i dugligt skick att ge sig ut i trafiken.
och 31 december 2006
Viktigt att själv bedöma hur läkemedlet
Den ändrade föreskriften trädde i kraft den 1 juli
påverkar körförmågan
2005. Under en övergångsperiod kan varningstri-
angeln existera parallellt med den varnande texten i
För att nyansera informationen om hur läkemedel på-
bipacksedeln. Senast den 31 december 2006 ska var-
verkar körförmågan, tas märkningen med varnings-
ningstriangeln vara borta från marknaden. Vid denna
trianglar bort. Istället kommer följande allmänna var-
tidpunkt ska samtliga läkemedel (med vissa undan-
ningstext att införas i bipacksedeln:
tag, se ovan) ha den nya varningstexten införd i bi-
”Du är själv ansvarig för att bedöma om du är i
packsedeln.
kondition att framföra motorfordon eller utföra
arbeten som kräver skärpt vaksamhet. En av faktorer-
Ytterligare information
na som kan påverka din förmåga i dessa avseenden är
Mer information samt ”Frågor & svar” för allmänhe-
användning av läkemedel på grund av deras effekter
ten finns på
och/eller biverkningar. Beskrivning av dessa effekter
Läkemedelsverkets webbplats www.mpa.se,
och biverkningar finns i andra avsnitt. Läs därför all
Apotekets webbplats www.apoteket.se och
FASS webbplats www.fass.se.
Ordinera extempore via e-recept nu möjligt
Nu kan man ordinera extemporeläkemedel via e-re-
ringen anges i doseringsfältet (max 254 tecken). Mer
cept. Då extempore kan vara olika typer av produkter
detaljerad information om extemporeförskrivning via
(krämer/kapslar etc) har Apoteket skapat ett gene-
e-recept finns i särtrycket, ”Licens eller extempore
riskt varugruppnummer för extemporeläkemedel,
när FASS inte räcker till”, från Apoteket.
Vnr 660000 Extempore e-förskrivning. Varunumret
OBS! Detta generiska extempore (varunumret)
finns i journalsystemets varuregister, förutsatt att va-
varunummer gäller enbart de beredningar som inte
ruregistret är uppdaterat. Beredningens komposition,
har något eget varunummer i varuregistret.
förpackningsstorlek, antal förpackningar samt dose-
6
Information från Läkemedelsverket 5:2005
Observanda
Fosamax och utbytbarhet
Fosamax och utbytbarhet
Läkemedelsverket fattade den 2 mars 2005 beslut om utbytbarhet för produkter innehållande alendronat. Be-
slutet fattades utifrån en bedömning av medicinsk likvärdighet och avsåg följande produkter:
Alendronat tablett 10 mg
Alenat, tablett 10 mg
Arrow Generics Ltd
Alendronat TEVA, tablett 10 mg
Teva Generics Sweden AB
Fosamax, tablett 10 mg
Merck Sharp & Dohme BV
Fosamax, tablett 10 mg
Orifarm AB
Alendronat tablett 70 mg
Alenat Veckotablett, tablett 70 mg
Arrow Generics Ltd
Fosamax Veckotablett, tablett 70 mg
Merck Sharp & Dohme BV
Fosamax Veckotablett, tablett 70 mg
Orifarm AB
Beslutet överklagades av Merck Sharp & Dohme (MSD). Den juridiska konsekvensen blev att Läkemedels-
verkets beslut avseende MSD:s två produkter inte trädde ikraft. Under tiden för den rättsliga prövningen eller
till dess att ytterligare generika eller parallellimporterade produkter tillförs grupperna kommer de därför ha
följande utformning:
Alendronat tablett 10 mg
Alenat, tablett 10 mg
Arrow Generics Ltd
Alendronat TEVA, tablett 10 mg
Teva Generics Sweden AB
Fosamax, tablett 10 mg
Orifarm AB
Alendronat tablett 70 mg
Alenat Veckotablett, tablett 70 mg
Arrow Generics Ltd
Fosamax Veckotablett, tablett 70 mg
Orifarm AB
Om en förskrivare på ett recept anger Fosamax kan apoteket välja Fosamax från Orifarm (parallellimport) eller
MSD. Väljer apoteket Fosamax Orifarm kan byte ske mot ett generika i aktuell utbytesgrupp. Fosamax Orifarm
kan däremot inte expedieras då den för närvarande inte tillhandahålls. Vill förskrivaren förhindra utbyte kan det
ske genom att skriva Fosamax + företagsnamn och sedan signera i rutan ”Får ej bytas ut”.
Vid förskrivning av elektroniska recept avses alltid en förpackning från ett specifikt företag. Vissa journalsys-
tem har inte Fosamax Orifarm såsom valmöjlighet då denna inte tillhandahålls. Förskrivs Fosamax MSD kan
farmaceuten av juridiska skäl inte göra något utbyte, utan kontakt med läkare, eftersom Fosamax MSD idag
inte finns med i utbytesgrupperna.
Information från Läkemedelsverket 5:2005 7
Observanda
Farmakopédag
Läkemedelsverket och
Svenska Farmakopékommittén inbjuder till
Farmakopédag måndag 5 december 2005
Vi kommer att informera om nyheterna i Europafarmakopén.
Vi tar även upp vad som pågår inom det Internationella Harmoniseringsarbetet.
Datum
Måndagen den 5 december 2005
Tid
09.00–16.30
Plats
Dragarbrunn, Atrium konferens, Dragarbrunnsgatan 46, Uppsala
Anmälan
Anmälningsblankett finns på vår webbplats, www.mpa.se.
Skicka, faxa eller e-posta in anmälningsblanketten.
Den ska vara Läkemedelsverket tillhanda senast den 14 november 2005.
Avgift
Faktura på anmälningsbeloppet 1150 kr (inkl. moms 280 kr) kommer att skickas ut efter mottagen anmälan.
I avgiften ingår för- och eftermiddagskaffe samt lunch. Skicka in din anmälan så snart som möjligt. Bekräftelse
och faktura kommer att skickas ut.
Information
För mer information, kontakta Malin Eriksson
E-post: xxxxx.xxxxxxxx@xxx.xx
Tel: 018-17 26 70
Du är välkommen att sända in önskemål om informationspunkter samt farmakopéfrågor Du vill diskutera och
ha svar på. Dessa vill vi ha senast den 14 november, då vi fastställer det slutliga programmet. Sprid gärna infor-
mationen till andra som kan vara intresserade.
Välkommen!
Preliminärt program
09:00–
12:00
Presentation av nyheter i Europafarmakopén
(edition 5, impurities, pilotprojektet väg 4, planering 6:e editionen m m )
Presentation av det europeiska farmakopésamarbetet nationellt och internationellt, svensk representation.
Certifieringsprogrammet; nyheter
Frågor och diskussion
12:00–
13:00
Lunch
13:00–
16:30
Internationella harmoniseringsarbetet.
Vacciner - från arbetet i vaccingruppen.
Alternativa mikrobiologiska metoder.
Brytbarhet av tabletter.
Frågor och diskussion.
Slutligt program fastställs med utgångspunkt från deltagarnas önskemål!
8
Information från Läkemedelsverket 5:2005
Behandling och profylax av influensa med
antivirala medel
— Behandlingsrekommendation
Den viktigaste åtgärden för att begränsa de medicinska konsekvenserna av influensa är årlig vaccination av de medicinska
riskgrupperna. Ytterligare ansträngningar för att öka vaccinationerna i Sverige behövs, konstaterades vid ett expertmöte,
som Läkemedelsverket anordnade i samarbete med Referensgruppen för Antiviral terapi (RAV) den 31 augusti 2005.
Antivirala läkemedel är ett komplement, men ersätter inte vaccination. En uppdatering av tidigare rekommendationer
har gjorts och avsnitt om fågelinfluensa och samhällets planering för en kommande influensapandemi har tillfogats.
Bakgrund
Influensa är en virusorsakad luftvägsinfektion som
drift). Vid större förändringar med byte av hela gener
sprider sig snabbt och ger upphov till omfattande epi-
(antigent skifte) uppstår ett virus som är helt gene-
demier. I tempererade klimat uppträder sjukdomen
tiskt skilt från tidigare cirkulerande stammar. Utbyte
företrädesvis under vinterhalvåret som relativt kort-
av gener mellan arter kan ske om ett däggdjur, oftast
variga (6–16 veckor) utbrott av varierande svårighets-
gris, infekteras samtidigt med ett fågelvirus och ett
grad. Andelen sjuka i befolkningen varierar vanligen
virus från människa. Även direkt överföring av intakt
mellan 2 och 15 %, vilket innebär att cirka 175 000
gris- eller fågelvirus till människa har förekommit.
till 1,3 miljoner människor i Sverige drabbas av in-
Hittills har direktöverförda fågelinfluensavirus inte
fluensa varje säsong. Den högsta incidensen ses i re-
haft kapacitet att smitta mellan människor i stor skala.
gel bland barn och ungdomar, som också står för en
Om ett antigent skifte inträffar och den nya virus-
stor del av smittspridningen. Komplikationer, främst
typen har förmåga att smitta effektivt mellan män-
sekundär bakteriell pneumoni, drabbar däremot hu-
niskor uppkommer epidemier med global utbredning
vudsakligen patienter med underliggande hjärt- och/
(pandemier).
eller lungsjukdom och äldre personer. Personer som
Under de senaste seklerna har det förekommit mel-
tillhör dessa ”riskgrupper” kräver oftare sjukhusvård
lan tre och fem influensapandemier per århundrade.
och står också för en väsentlig del av den ökade död-
De mest kända under 1900-talet är Spanska sjukan
lighet som ses i samband med influensa. Närmare
(H1N1, 1918), Asiaten (H2N2, 1957) och Hong-
90 % av influensarelaterade dödsfall inträffar hos per-
kong (H3N2, 1968). Spanska sjukan var den svåraste,
soner över 65 års ålder. Under vintrar med hög influ-
med en insjuknandefrekvens på 40–60 %. Drygt 1 %
ensaaktivitet registreras i Sverige upp till cirka 4 000
av de sjuka avled, vilket resulterade i 20–40 miljoner
fler dödsfall än under motsvarande tidsperioder utan
dödsfall över världen. Virus överfördes troligen från
laboratorieverifierad influensa. Trots att influensa hos
fågel till gris, och därefter till människa. De övriga två
för övrigt friska ungdomar och vuxna i regel är en
pandemierna har orsakats av virus som innehållit gen-
självbegränsande sjukdom, ger den upphov till en
fragment från både humana virus och fågelvirus. Den
betydande morbiditet med omfattande sjukfrånvaro
senaste pandemin 1977 blev mycket mild, och orsa-
från skolor och arbetsplatser.
kades av H1N1. Både H1N1 och H3N2 har fortsatt
Influensavirus är ett RNA-virus tillhörande famil-
att cirkulera och ger årliga utbrott. Då det snart är
jen orthomyxovirus och förekommer i tre typer – A,
30 år sedan en ny subtyp introducerades, kan en ny
B och C. Sjöfåglar är naturlig värd för influensa A
pandemi förväntas drabba jorden inom de närmaste
och många djurslag kan infekteras med vissa av de
decennierna. För närvarande cirkulerar ett högpato-
många subtyper av influensa A som finns hos fåglar,
gent fågelvirus (H5N1) bland tama och vilda fåglar i
medan influensa B och C har människa som huvud-
Sydostasien och Ryssland, s.k. aviär influensa. Hittills
saklig värd. Influensa A och B orsakar epidemier,
har mer än 100 kliniska fall av fågelinfluensa H5N1
medan influensa typ C vanligen ger en lindrig övre
konstaterats hos människa och dödligheten har varit
luftvägsinfektion och därför sällan diagnostiseras. In-
mer än 50 % (för aktuell information www.who.int/
fluensavirus har två ytantigener: hemagglutinin (H)
csr/disease/avian_influenza/country/en). Majorite-
som binder virus till receptorer på cellytan och neu-
ten av dessa fall hade varit i kontakt med sjuka fåglar.
raminidas (N) som är av betydelse för frisättningen av
Ingen effektiv smittspridning mellan människor har
nybildade viruspartiklar från den infekterade cellen.
uppkommit trots att virus har funnits i området se-
Det finns 16 olika H- och nio olika N-typer hos fåg-
dan 1997, men seroepidemiologiska studier saknas.
lar. Dessa kan kombineras till mer än 80 s.k. subtyper.
Det är osäkert hur stort pandemihot H5N1 utgör.
Tre (H1N1, H2N2, H3N2) har givit upphov till om-
De kända pandemierna har orsakats av influensavirus
fattande epidemier hos människor. Båda antigenerna
med H1, H2 eller H3. Asiatens virus (H2) försvann
undergår kontinuerligt förändringar, vilket är orsak
1968, och en stor del av jordens befolkning saknar
till de årliga influensaepidemierna. Förändringarna
skydd mot detta virus. Möjligen är en återkomst av
sker genom ansamling av punktmutationer i gener
H2 det största hotet för närvarande. Eftersom in-
som kodar för influensavirus ytproteiner (antigen
fluensa B endast undergår små förändringar har den
Information från Läkemedelsverket 5:2005 9
Behandlingsrekommendation
Behandling och profylax av influensa med antivirala medel
inte samma förmåga som influensa A att åstadkomma
Profylax
stora epidemier.
Den viktigaste åtgärden för att begränsa de medicin-
Influensa A och B ger samma kliniska sjukdoms-
ska konsekvenserna av influensa är årlig vaccination
bild (se nedan). Influensavirus replikerar i luftvägse-
av de medicinska riskgrupperna (se Faktaruta 1).
pitelet men därifrån infekteras även monocyter-mak-
Antivirala läkemedel är ett komplement, men ersätter
rofager som förs till blodbanan. I dessa produceras
inte vaccination. Vaccination är det mest kostnadsef-
mycket lite virus, men immunsvaret stimuleras varvid
fektiva sättet att förebygga och minska de skadliga
cytokiner frisätts, vilket ger upphov till de typiska in-
verkningarna av influensa.
fluensasymtomen. Smittspridningen mellan männis-
Vacciner
kor är mycket snabb och sker via dropp/aerosol- och
För närvarande används inaktiverade influensavacci-
kontaktsmitta. Inkubationstiden är kort – en till tre
ner, som innehåller två influensa A-stammar och en
dagar. Virusutsöndringen är störst från ett dygn före
influensa B-stam (trivalent). De stammar som ingår
till två dygn efter insjuknandet, men kan pågå ytter-
utväljs årligen av WHO och anpassas efter cirkuleran-
ligare några dagar. Barn med förstagångsinsjuknande
de stammar. Valet av influensastammar måste göras
utsöndrar virus under längre tid. Mängden virus som
minst sex månader före vaccinationsstart på grund av
utsöndras samvarierar hos immunfriska individer med
produktionstiden. Vaccinet framställs genom virus-
febern.
odling i befruktade hönsägg. Virus inaktiveras, sön-
Epidemiologisk övervakning med typning av
derdelas och renas så att framför allt ytproteiner ingår
virus
i vaccinet. Det finns för närvarande två vaccintyper,
Influensavirus förekommer vanligen i cirka sex till
”splitvaccin” och ”subunitvaccin”. I subunitvaccinen
16 veckor under epidemitid
. Epidemiutvecklingen
har ytantigenerna hemagglutinin och neuramini-
är olika år från år. De flesta sjukdomsfallen inträffar
das ytterligare framrenats. De är i princip likvärdiga,
inom fem till tio veckor efter det att de första fal-
men viss tveksamhet avseende immunogeniciteten av
len har diagnostiserats, varefter aktiviteten avtar. Den
subunitvaccin hos barn <4 år finns, och ytterligare
epidemiologiska anamnesen är väsentlig vid diagnos-
studier pågår. Dessutom finns ett subunitvaccin med
tik av influensa. Övervakning av det epidemiologiska
immunstimulerande tillsats (adjuvans) godkänt för
läget nationellt och lokalt är därför viktig.
vaccination av personer över 65 år. Oavsett vaccintyp
Sedan vintersäsongen 1999–2000 rapporterar cirka
rekommenderas en dos till vuxna och två doser till
2 % av Sveriges distrikts/familjeläkare till landsting-
barn <3 år. Vaccinationens skyddande effekt mot de
ens smittskyddsläkare hur många av veckans patien-
ingående influensastammarna kvarstår cirka ett år.
ter som haft misstänkt influensa. De mikrobiologiska
Den årliga framställningen av influensavaccin krä-
laboratorier som utför influensadiagnostik rappor-
ver enorma kvantiteter av ägg (~350 miljoner globalt)
terar veckovis antalet influensadiagnoser. Insamlade
och är tidsödande. Det tar flera månader att ta fram
data sammanställs vid Smittskyddsinstitutet (SMI) i
tillräcklig mängd vaccin. Därför har man utvecklat
en veckorapport som publiceras på SMIs webbplats,
tekniker för att odla influensavirus i cellkulturer för
www.smittskyddsinstitutet.se. SMI rapporterar också
vaccinframställning (1). Detta innebär potentiella
veckovis data från Sverige till Världshälsoorganisatio-
fördelar eftersom framställningen kan ske oberoende
nen (WHO, www.who.int) och European Influenza
av tillgången på hönsägg. Två cellodlade vacciner är
Surveillance Scheme (EISS, www.EISS.org).
på väg att introduceras på marknaden.
Även typningen av influensavirus är av stor bety-
Ett levande influensavaccin som administreras in-
delse, särskilt i början av en epidemi. Att karaktärisera
tranasalt (FluMist) har nyligen godkänts i USA för
aktuella virusisolat kan ses som en viktig beredskaps-
barn >5 år och vuxna <49 år (2). Vaccinet odlas på
åtgärd, dels för att tidigt upptäcka eventuella avvikel-
ägg och innehåller försvagade virusstammar som inte
ser från de stammar som ingår i aktuellt vaccin, dels
kan replikera vid den temperatur som råder i de ne-
för att så tidigt som möjligt kunna avgöra om en ny
dre luftvägarna. Kliniska studier i de medicinska risk-
stam kommit till landet.
grupperna pågår.
Faktaruta 1. Målgrupper för vaccination
Socialstyrelsens allmänna råd avseende influensavaccination [SOSFS 1997:21 (M)].
Vaccination anges vara av värde för följande grupper:
• Patienter med kronisk hjärt- och/el er lungsjukdom, i synnerhet de med hjärtsvikt och nedsatt lungfunktion.
• Personer över 65 års ålder. Indikationen ökar med stigande ålder och vid underliggande kronisk sjukdom.
Även patienter med andra kroniska sjukdomar som diabetes mellitus eller gravt nedsatt infektionsförsvar (av
sjukdom eller medicinering) kan rekommenderas vaccination mot influensa, men värdet av vaccinationen är ej
lika väl dokumenterat som för de ovan nämnda grupperna. All vaccination är frivillig och görs efter individuellt
ställningstagande.
10 Information från Läkemedelsverket 5:2005
Behandlingsrekommendation
Behandling och profylax av influensa med antivirala medel
Ett vaccin för en pandemisk influensa kommer att
undersökta landsting avseende personer >65 år va-
skilja sig i flera avseenden från de vacciner som pro-
rierade år 2004 mellan 35 och 68 %, vilket motsva-
duceras idag för de årliga utbrotten. Ett pandemivac-
rar 52 % på riksnivå. Hur många som vaccinerats i de
cin kommer bara att innehålla en virustyp (monova-
övriga medicinska riskgrupperna är ej klarlagt. I vissa
lent). Sannolikt kommer det att innehålla adjuvans så
europeiska länder och i Nordamerika har man nått en
att mängden vaccinantigen kan reduceras. Den till-
täckning på 60–80 %. Ytterligare ansträngningar för
gängliga mängden vaccinantigen kommer därigenom
att öka vaccinationerna i Sverige behövs. Förutom de
att räcka till fler individer. För att uppnå skyddseffekt
i SOSFS 1997:21 definierade medicinska riskgrup-
krävs troligen att två doser ges med några veckors
perna bör vaccination också övervägas av anhöriga
mellanrum.
och sjukvårdspersonal som kan komma att utsätta
Skyddseffekt av vacciner
personer inom riskgrupperna för smitta (4–6).
Det tar upp till två veckor att utveckla skydd efter
Unga och medelålders, tidigare friska personer löper
vaccination. En nackdel med dagens influensavacci-
inte någon väsentlig risk för al varliga komplikationer
ner är det kortvariga och subtypsspecifika skyddet.
vid influensa. Eftersom den enskilda individen vanligen
Ny vaccination måste därför genomföras inför varje
insjuknar i symtomatisk influensa bara vart 10:e til 20:e
influensasäsong. Senare års studier har visat att ef-
år är årlig vaccination inte medicinskt motiverad. Å andra
fekten av vaccination på mortalitet förstärks hos per-
sidan är biverkningarna av vaccinet beskedliga och det
soner som vaccineras årligen (3). Flera faktorer styr
finns inga andra kontraindikationer än uttalad äggal er-
vaccinationseffekten. De två viktigaste är:
gi (Information från Läkemedelsverket nr 2001;12(3)
• Överensstämmelsen mellan epidemiskapande
www.mpa.se/workshops/reko/vaccination.shtml).
stam och den/de som ingår i vaccinet. Vanligen
Det finns inget stöd för att årlig vaccination skul e vara
(9 influensasäsonger av 10) är den god, men
skadlig.
vissa år är den inte optimal. Det medför att vac-
Barn som til hör medicinska riskgrupper bör erbjudas
cinets skyddseffekt mot influensa blir lägre och
vaccination. Detta glöms ofta bort. Även barn med an-
flera genombrott av sjukdomen inträffar.
dra svåra metabola sjukdomar än diabetes, liksom barn
• Värdfaktorer såsom hög ålder och olika former
med al varliga medfödda missbildningar och behov av
av nedsatt immunförsvar ger sämre vaccinskydd.
upprepad kirurgi och barn med grav neuromuskulär
Skyddseffekten av influensavaccination har på grund
sjukdom,
bör erbjudas vaccination. Vaccination kan ges
av ovanstående faktorer i kliniska studier varierat mel-
från sex månaders ålder (två doser).
lan 0 och 90 %! För personer under 65 år med nor-
I andra länder har man utvidgat målgrupperna för
malt immunförsvar anges ett genomsnittligt skydd
årlig influensavaccination. I USA inkluderas även barn
mot laboratorieverifierad influensa på 60–80 %,
i åldrarna sex til 23 månader, kvinnor som är el er för-
medan effekten mot klinisk influensa är betydligt
väntas bli gravida under influensasäsongen, individer i
lägre. Skyddseffekten mot influensainsjuknande är
åldrarna 50 til 64 år samt personer som lever med el-
betydligt sämre hos äldre individer. Emellertid har
ler vårdar (hälso- och sjukvårdspersonal), personer som
vaccination visats resultera i 50–70 % minskning av
til hör de medicinska riskgrupperna (7). Att gravida
risken för pneumoni, 30–70 % reduktion av behovet
rekommenderas vaccination baseras på data som visar
av sjukhusvård och 30–50 % av dödlighet hos per-
att de löper en ökad risk för influensa-associerade kom-
soner med ökad risk för komplikationer (”riskgrup-
plikationer (8–10). Vaccination rekommenderas oavsett
per”). Angivna procentsiffror för riskminskningen av
graviditetens längd och inga oönskade effekter av vac-
komplikationer gäller den relativa riskreduktionen.
cinet på fostret har rapporterats. Motsvarande rekom-
Den absoluta riskreduktionen varierar med influ-
mendationer finns inte i Sverige.
ensasjukdomens prevalens, virus patogenicitet och
Klinisk diagnostik och sjukdomsförlopp
stamanpassningen i vaccinet. I en nyligen publicerad
metaanalys av influensavaccination av äldre personer
Influensadiagnostik (se Faktaruta 2).
var skyddseffekten mot komplikationer lägre, men
De typiska kliniska symtomen vid influensa är
fortfarande signifikant (3B). Resultat från andra stu-
inte unika. Andra sjukdomar kan ge en likartad bild.
dier, inklusive en ännu opublicerad i Stockholm, ty-
Snabba metoder (10–30 minuter) för influensadiag-
der på att influensavaccinets effektivitet avseende att
nostik finns nu tillgängliga för primärvården, men
förhindra död är betydligt lägre (15–20 %) än tidiga-
har låg känslighet och är ännu otillräckligt utvärde-
re beräknat. Befintliga data har sannolikt övertolkats,
rade i rutinbruk. Därför måste antiviral behandling
men ytterligare analyser och nya studier behövs för
ännu oftast ges på empirisk grund. Snabbtesterna kan
att klarlägga vaccinationseffekten mot död.
dock ha en plats i akutdiagnostiken som patientnära
Uppskattningsvis hör 1,8 miljoner människor i
test särskilt på sjukhus under jourtid och för isolering
Sverige till de av Socialstyrelsen definierade riskgrup-
av influensasjuka patienter. Influensasjukdomens kli-
perna för komplicerad influensasjukdom. I vilken
nik varierar avsevärt från en allvarlig systemsjukdom
utsträckning dessa grupper årligen vaccineras varie-
till lindrig övre luftvägsinfektion. Många ungdomar
rar mellan landstingen. Vaccinationstäckningen i 18
och vuxna får den klassiska influensabilden som ka-
Information från Läkemedelsverket 5:2005 11
Behandlingsrekommendation
Behandling och profylax av influensa med antivirala medel
rakteriseras av ett plötsligt insjuknande med allmän
ännu mer ospecifika med slöhet, ovilja att äta, gråblek
sjukdomskänsla, frysningar och snabbt stigande feber
hudfärg och irritabilitet. Sjukhusinläggning för ob-
(39–40ºC), varefter kraftig huvudvärk och svår mus-
servation och utredning är ofta nödvändig.
kelvärk (även i ögonmusklerna) tillkommer. Redan
Bakteriella komplikationer i form av sinuit och
vid sjukdomsdebuten har flertalet patienter lindriga
– framför allt hos barn – mediaotit kan förekomma
luftvägssymtom som successivt ökar de närmaste da-
tidigt i förloppet. Hos förskolebarn förekommer även
garna. Hård torrhosta är särskilt framträdande, ofta
myosit.
i kombination med retrosternal smärta, som tecken
I de medicinska riskgrupperna är sekundära kom-
på trakeit. Halsont och snuva är också vanligt. I nor-
plikationer vanliga. De kan uppkomma redan efter
malfallet varar febern tre till fem dagar och som regel
några få dagar, framför allt som bakteriell pneumoni
är den akuta sjukdomen över efter fem till sju dagar.
(cirka 5 %),
vilket är den viktigaste orsaken till in-
Postinfektiös asteni under ett par veckor är vanligt.
fluensarelaterade dödsfall
. En sällsynt men fruktad
Inom EU pågår ett arbete att få data om rappor-
komplikation är snabbt förlöpande viruspneumonit,
terade smittsamma sjukdomar mer jämförbara mellan
som har dålig prognos. Ovanliga manifestationer vid
olika länder. EU-kriterier för influensa har utvecklats
influensa är myokardit och encefalit.
som är ämnade att användas för vilka fall som ska rap-
Infektioner med högpatogen fågelinfluensa har hos
porteras. De är inte avsedda att användas som en del
människa uppvisat en mångfacetterad klinisk bild från
i den kliniska diagnostiken (se Addendum, Faktaruta,
lindriga symtom med feber, halsont, hosta, ögonin-
EU kriterier för influensa se sid 22).
flammation och mag-tarmbesvär till en livshotande
Hos barn och äldre personer är symtombilden vid
sjukdom med fatal utgång (11–13), se Faktaruta 3.
influensa mer okarakteristisk. Äldre patienter har ofta
I utbrotten av högpatogen H5N1-influensa i Asien
lägre feber och mindre uttalad hosta. Gastrointesti-
2003–2005 har hittills (5 augusti 2005) 57 dödsfall
nala symtom är vanliga hos barn, liksom matnings-
hos 112 insjuknade (50 %) rapporterats. Majoriteten
problem med åtföljande dehydrering. Kramper kan
av patienterna hade symtom på allvarlig respiratorisk
förekomma i anslutning till febern, och influensain-
sjukdom med feber, hosta och andningssvårigheter
fektion är den vanligaste orsaken till komplicerade fe-
samt lungröntgenförändringar. Andra symtom såsom
berkramper. Hos de yngsta spädbarnen är symtomen
halsont, snuva, muskelvärk och diarré förekom hos
Faktaruta 2. Klinisk influensadiagnostik
Epidemiologi
Pågående virologiskt verifierad influensaepidemi i samhället eller vistelse/resa i område med pågående influ-
ensa inom fem dagar före insjuknandet.
Inkubationstid tre dagar.
Symtombild hos barn
Barn <2 år
•
Slöhet, ovilja att äta, färgskiftning och irritabilitet
•
Med stigande ålder mer typisk bild med feber och luftvägssymtom
Barn 2–12 år
•
Feber, feberkramper
•
Kräkningar, diarré, matningssvårigheter (dehydrering)
•
Andningsbesvär, hosta
•
Ofta mindre allmänpåverkan än hos vuxna.
Symtombild hos ungdomar och vuxna
Initialsymtom:
Plötsligt insjuknande
Frysningar, hög feber 38–40ºC
Huvudvärk och muskelvärk
Milda luftvägssymtom
Efter något dygn:
Torrhosta och ont bakom bröstbenet
Nasala symtom och halsont
Feber + hosta har högst prediktivt diagnostiskt värde
Symtombild hos äldre
Atypisk och mer diffus klinisk bild
Långsammare insättande feber som inte blir så hög som hos yngre
Allmän sjukdomskänsla
Desorientering.
12 Information från Läkemedelsverket 5:2005
Behandlingsrekommendation
Behandling och profylax av influensa med antivirala medel
cirka en tredjedel av patienterna. Allvarlig njursvikt
tod. Virusodling finns ännu i rutindiagnostik vid ett
och hjärtsvikt samt enstaka fall med encefalit eller fe-
fåtal laboratorier i Sverige. Resultatet av antigentest-
bril diarré utan samtidiga luftvägssymtom har också
ning eller nukleinsyraamplifiering kan normalt erhål-
beskrivits. Patologiska laboratorieprover som rappor-
las samma dag som provet når viruslaboratoriet el-
terats inkluderar lymfopeni, trombocytopeni, steg-
ler dagen efter. Odling besvaras inom 14 dagar, men
rade leverprover, förhöjt serumkreatinin samt störd
besked om preliminärt positivt fynd ges vanligtvis
glukosbalans.
tidigare. Nya snabbdiagnostiska metoder (10–30 mi-
Under epidemitider är det i allmänhet ganska lätt
nuter) har introducerats, men används ännu relativt
att ställa diagnos hos patienter med den typiska kli-
lite. Serologisk diagnostik kräver akut- och konvale-
niska symtombilden, speciellt några dygn efter sym-
scentprov och har därför inte någon plats i akutdiag-
tomdebut. I insjuknandefasen kan bilden dock vara
nostiken.
okarakteristisk och förväxlas med andra luftvägsinfek-
I normalfallet är nasofarynxsekret det bästa prov-
tioner, särskilt de orsakade av RS-virus, adenovirus,
materialet för såväl odling och antigendetektion som
metapneumovirus, parainfluensa och mykoplasma.
påvisande av virusgenom, men svalg- eller bronk-
Framför allt hos äldre patienter och småbarn är RS-
sköljvätska, alternativt trakealsekret, kan också använ-
virusinfektion en viktig differentialdiagnos. Hos små
das. Avgörande är att tillräcklig mängd celler erhålles
barn kan influensa leda till att en underliggande sjuk-
vid provtagningen. Nya data talar för att pinnprov
dom manifesterar sig för första gången. Allvarliga
på nässekret är jämförbart med nasofarynxaspirat vid
sjukdomar såsom bakteriell pneumoni, sepsis och ma-
PCR-diagnostik.
laria kan debutera med influensaliknande symtom.
Aviär influensa kan påvisas med alla ovanstående
Eftersom ställningstagande till antiviral terapi
metoder, men de ger ingen information om sub-
måste göras så snart som möjligt blir den kliniska
typ. Fynd av influensa A-virus måste därför subty-
diagnostiken ofta svår. I de stora kliniska behand-
pas om fågelinfluensa misstänks. Detta kan ske med
lingsstudierna med neuraminidashämmare var den
hemagglutinations-inhibitionstest, subtypsspecifik nu-
diagnostiska träffsäkerheten för influensa på basis
kleinsyraamplifiering el er immunofluorescens. På SMI
av enbart kliniska symtom i epidemitider i medeltal
används specifik nukleinsyraamplifiering eller sekven-
60–70 % hos i övrigt friska personer i arbetsför ålder.
sering av H-genen. Flera andra virologiska laborato-
I en subanalys hade feber i kombination med hosta
rier i Sverige håller på att sätta upp subtyps-specifika
högst prediktivt värde (79 %) för influensa med en
analysmetoder.
sensitivitet på 64 % och specificitet på 67 %.
När bör virologisk laboratoriediagnostik utföras?
Laboratoriediagnostik
Provtagning rekommenderas på index-fall för att
Laboratoriediagnostik med CRP och LPK kan i ut-
säkerställa influensaförekomst i samhället och vid
valda fall vara av värde. CRP är i regel <100 mg/L
utbrott på institutioner. Sedan ett influensautbrott
och den vita blodbilden normal eller visar leukopeni.
laboratoriemässigt verifierats behöver provtagning
Virologisk diagnostik
inte ske i typiska fall. Virologisk diagnostik bör dock
ske även fortsättningsvis vid atypisk sjukdom, hos in-
Referensmetod för påvisande av influensainfektion
läggningsfall och hos svårt sjuka och personer inom
anses för närvarande vara virusodling, men den hål-
medicinska riskgrupper såsom immunsupprimerade
ler på att ersättas av nukleinsyraamplifiering (Polyme-
och hjärt-lungsjuka.
rase Chain Reaction, PCR, samt andra metoder). I
Metoder för resistensbestämning
viruslaboratoriet påvisas influensa A och B snabbast
Metoder för resistensbestämning finns på Smitt-
med antigentest (immunofluorescens (IF)-test eller
skyddsinstitutet. Genom sekvensering av neuramini-
kommersiella antigentester) på nasofarynxaspirat.
dasgenen kan kända mutationer som ger resistens mot
Flera laboratorier har under senare år valt att använda
neuraminidashämmare lätt identifieras. Motsvarande
nukleinsyraamplifiering som enda diagnostiska me-
Faktaruta 3. Klinisk symtombild vid fågelinfluensa hos människa
Högpatogen, aviär influensa orsakad av A/H5N1 hos människa (Sydostasien 2003–2005)
• Cirka tre dagars inkubationstid.
• Feber, andnöd som tecken på lunginflammation, diarré, allmän organsvikt med lever- och njurpåverkan.
• Trombocytopeni, leukopeni.
• Lindrigare fall med mera typiskt influensainsjukande har förekommit.
• Två fall av dödlig encefalit.
Högpatogen, aviär influensa orsakad av A/H7N2 (Nederländerna 2003)
• Konjunktivit (>80 fall)
• Ett par fall med feber och luftvägssymtom
• Ett dödsfall med pneumoni
Information från Läkemedelsverket 5:2005 13
Behandlingsrekommendation
Behandling och profylax av influensa med antivirala medel
analys kan göras för att detektera amantadinresistens.
av fallen, eftersom virologiskt snabbtest oftast saknas.
Tester som påvisar om neuraminidasets funktion eller
Detta innebär att ITT-analysen ger bäst information
virustillväxt inhiberas av substansen finns också, men
om det förväntade kliniska värdet av antiviral influen-
standarder för dessa tester saknas internationellt. Re-
sabehandling i en patientpopulation.
sistensbestämning har för närvarande ingen plats vid
Kontrollerade studier speciellt inriktade på att utvär-
okomplicerad influensainfektion, men bör diskuteras
dera om antivirala läkemedel minskar risken för se-
med SMI i speciella situationer såsom vid långvarig
kundärkomplikationer och ökad dödlighet har inte
virusutsöndring, hos behandlade immunsupprime-
utförts.
rade patienter, eller vid svårkontrollerat utbrott på
Zanamivir (Relenza)
institution där antiviral profylax givits. Gravt im-
Zanamivir är hämmare av enzymet neuraminidas och
munsupprimerade patienter är en riskgrupp där spe-
är verksamt mot både influensa A och B. Medlet ges
ciell övervakning är indicerad. Resistensövervakning
som oral inhalation via en diskhaler på samma sätt som
är en viktig epidemiologisk fråga som bör samordnas
vid behandling av astma. Denna administrationsväg
nationellt.
kan innebära svårigheter för en del patienter, varför
Antiviral behandling av influensa
noggrann instruktion krävs. Doseringen är två inha-
lationer två gånger dagligen under fem dagar. Varje
I samband med sjukvårdskontakt bör patienter som
avdelad dos innehåller 5 mg zanamivir (se Tabell I).
tillhör de medicinska riskgrupperna informeras om
För att ha effekt måste läkemedlet sättas in så tidigt
att de bör vaccineras mot influensa men också:
som möjligt och senast inom 48 timmar efter sym-
• att de trots vaccination kan drabbas av influensa
tomdebut. I Europa är medlet för närvarande endast
• att antiviral terapi finns tillgänglig om de drab-
godkänt som terapi för vuxna. I vissa andra länder är
bas av influensa, men att behandlingseffekten är
zanamivir godkänt för profylax hos vuxna, men också
begränsad
för behandling av barn från fem års ålder.
• att antiviral terapi måste påbörjas så tidigt som
De kliniska studierna inkluderade för övrigt friska
möjligt i sjukdomsförloppet (senast inom 48 tim-
yngre vuxna med influensaliknande sjukdom. Den
mar efter symtomdebut) för att ha effekt
uppmätta terapieffekten hos influensapositiva patien-
• att influensaläkemedel inte har någon effekt mot
ter var en reduktion av sjukdomsdurationen på i ge-
andra luftvägsinfektioner
nomsnitt 1,5 dagar (variation: 1–2,5 dagar) och en
Fortlöpande information om influensa till allmän-
lindring av symtomen. I ITT-analysen av alla patien-
heten kommer i epidemitider via massmedia från
ter med kliniskt misstänkt influensa visades likartad
sjukvården såsom allmänläkare, distriktssköterskor,
effekt i två av huvudstudierna, medan sjukdomsdu-
smittskyddsläkare, infektionskliniker eller läkeme-
rationen endast reducerades 0,5 dagar jämfört med
delskommittéer. Information om epidemiläget ges
placebo i den största studien. Detta utfall erhölls i
veckovis från vecka 40 till vecka 20 på Smittskyddsin-
studier med strikta inklusionskriterier, som inte till-
stitutets hemsida, www.smittskyddsinstitutet.se.
lämpas i klinisk praxis, varför en lägre vinst kan för-
Läkemedel
väntas vid rutinbruk. Majoriteten av patienterna i
Allmänt
studierna hade influensa A. I en poolad analys av alla
Läkemedel mot influensa har effekt endast på virus-
patienter med influensa B (n=163) visades att tiden
replikationen. Influensavirus förökar sig framför allt
till symtomlindring förkortades med 2,0 dagar (95 %
under de första dagarna efter symtomdebut, varefter
KI: 0,50–3,50; p=0,029) jämfört med placebo. I en
virusmängden snabbt minskar till låga nivåer. Det är
publicerad studie beskrivs effekten av zanamivir hos
således viktigt att sätta in antiviral terapi så snart som
influensasjuka barn vara likartad den hos vuxna med
möjligt och senast inom 48 timmar efter symtomde-
1,25 dagars (95 % konfidensintervall (KI) 0,50–2,0)
but. I kliniska studier av neuraminidashämmarna har
förkortning av sjukdomsdurationen, men data har
det visats att ju tidigare behandlingen inleds desto
hitintills bedömts som otillräckliga för ett godkän-
större är terapivinsten. Hos tidigare friska personer
nande i Europa.
med influensa kunde ingen effekt i jämförelse med
I de patientgrupper där störst behov av behandling
placebo påvisas om terapin sattes in efter 48 timmar.
bedöms föreligga, till exempel äldre och hjärt- och
Effekten av läkemedelsbehandling har i de kliniska
lungsjuka, är dokumentationen mer begränsad. I en
studierna presenteras på två sätt,
dels som effekten
nyligen genomförd behandlingsstudie med zanami-
hos de patienter som visats ha aktuell influensain-
vir inkluderades 525 patienter med lindrig/moderat
fektion (influensapositiva),
dels som effekten hos de
astma och/eller kroniskt obstruktiv lungsjukdom
patienter som inkluderats i studierna, Intention-To-
(KOL). Sjukdomstiden förkortades med 1,5 dagar
Treat (ITT). Den senare analysen är sannolikt den
(95 % KI: 0,5–3,25) hos de med verifierad influensa,
som bäst motsvarar förhållandet i den kliniska situa-
medan en icke-signifikant reduktion på 1,0 dagar
tionen. Korrekt diagnos ställs där bara i cirka 60 %
(95 % KI: 0,0–2,0) uppmättes i ITT-analysen. Ing-
14 Information från Läkemedelsverket 5:2005
Behandlingsrekommendation
Behandling och profylax av influensa med antivirala medel
en signifikant reduktion av sekundärkomplikationer
än ett år och för profylax mot influensa hos (vuxna
kunde påvisas vid jämförelse med placebo. Säkerhets-
och ungdomar) personer äldre än 13 år. Utvärdering
mässigt, inkluderande frekvensen av respiratoriska
av profylaktisk behandling av barn pågår.
biverkningar, förelåg inga skillnader mellan zanami-
De kliniska studier som utvärderat effekt och sä-
vir och placebo. En studie där äldre patienter (>65
kerhet av oseltamivir har inkluderat flera olika popu-
år) med influensasymtom (n=358) inkluderades har
lationer såsom för övrigt friska vuxna (n=1355), barn
också utförts. Den avbröts dock i förtid på grund av
(n=698), och patienter i de medicinska riskgrup-
rekryteringsproblem och ingen effekt av zanamivir
perna: äldre individer över 65 år (n=741), barn med
på sjukdomsdurationen kunde påvisas. Incidensen
astma (n=334) samt vuxna patienter med hjärt- och/
av sekundära komplikationer reducerades numerärt
eller lungsjukdom (n=404). Den uppmätta effekten
men inte signifikant i zanamivirgruppen jämfört med
av oseltamivir i de kliniska studierna hos individer
placebo. Inga oväntade biverkningar rapporterades i
med verifierad influensa varierade beroende på pa-
denna population av äldre patienter. I en poolad analys
tientpopulationen. En förkortning av sjukdomsdura-
av alla högriskpatienter som inkluderats i det kliniska
tionen på i genomsnitt 1,0–1,5 dagar uppmättes hos
programmet uppmättes en positiv behandlingseffekt
influensapositiva vuxna och barn, medan effekten i
med 1,5 dagars förkortning av sjukdomsdurationen
ITT-analysen varierade mellan 0,7–0,9 dagar. Ingen
i både den influensapositiva- och ITT-populationen.
effekt av oseltamivir på incidensen av sekundärkom-
En signifikant reduktion i incidensen av komplikatio-
plikationer kunde påvisas i de enskilda studierna hos
ner (främst bronkit) som krävde antibiotika påvisades
vuxna, medan incidensen av akut mediaotit reduce-
också i zanamivirgruppen (17 %) jämfört med pla-
rades signifikant från 27 % i placebogruppen till 13 %
cebo (23 %) (p=0,028) De genomförda studierna är
hos oseltamivirbehandlade barn. I en sammanlagd
inte tillräckligt stora för att kunna visa om zanamivir
analys av alla kontrollerade kliniska studier på vuxna
påverkar mortaliteten vid influensa.
och ungdomar befanns oseltamivir reducera inciden-
Säkerhetsmässigt har inga specifika biverkningar
sen av nedre luftvägsinfektioner (främst bronkit) som
eller läkemedelsinteraktioner identifierats. Efter god-
krävde antibiotika från 12,7 % i placebogruppen till
kännandet har dock sällsynta fall av bronkobstruktion
8,6 % i den oseltamivir-behandlade populationen
och bronkospasm, trånghetskänsla i halsen och hud-
(p=0,0012).
utslag rapporterats. (Se produktresumé för Relenza
Majoriteten av patienterna i studierna hade influ-
www.mpa.se/humanlakemedel/humspc.shtml).
ensa A. I en poolad analys av alla patienter med in-
Inga data finns vad gäller behandling av fågelin-
fluensa B, totalt 15 % av den influensapositiva popu-
fluensainfektioner hos människa. Eftersom zanamivir
lationen, visades att sjukdomen förkortades med 0,7
appliceras lokalt i luftvägarna bedöms medlet inte vara
dagar (95 % KI 0,1–1,6 dagar) i oseltamivirgruppen
lämpligt för behandling av högpatogena influensavi-
jämfört med placebo.
rustyper med förmåga till systemspridning (viremi),
Hos de medicinska riskgrupperna, patienter >65
vilken sannolikt är fallet med de allvarliga H5N1-in-
år, patienter med kronisk hjärt- och/eller lungsjuk-
fektioner som hittills dokumenterats hos människa.
dom och barn med astma, kunde ingen signifikant
En intravenös beredning av zanamivir utvärderas för
effekt av oseltamivir påvisas i den primära effektva-
närvarande i kliniska studier.
riabeln, medianduration av influensasjukdomen. För
Oseltamivir (Tamiflu)
det sekundära effektmåttet, duration av feber, sågs
Oseltamivir är en neuraminidashämmare som är verk-
dock en signifikant förkortning på i genomsnitt 1,0
sam mot både influensa A och B, men med relativt
dag i den oseltamivirbehandlade gruppen jämfört
sett större effekt mot influensa A
in vitro. Medlet
med placebo. Avseende incidensen av komplikationer
ges oralt som en prodrog, en etylester, som efter pas-
i nedre luftvägarna som behandlades med antibiotika
sage i tarmen snabbt omvandlas till aktiv substans.
(främst bronkit), sågs hos äldre individer >65 år en
Läkemedlet finns tillgängligt som kapsel (75 mg)
signifikant reduktion (från 19 % i placebogruppen till
och mixtur (12 mg/mL). Dosering för behandling
12 % i oseltamivirgruppen, p=0,0156). Hos patien-
av vuxna är en kapsel, 75 mg 2 gånger dagligen och
ter med underliggande hjärt- och/eller lungsjukdom
för profylax 75 mg 1 gång dagligen. Till barn 1–12 år
kunde däremot ingen effekt av oseltamivir på kompli-
doseras oseltamivir efter kroppsvikt i dosen 2 mg/kg
kationsfrekvensen i nedre luftvägarna påvisas.
2 gånger per dag (se Tabell I). Oseltamivir rekom-
Genomförda studier är inte tillräckligt stora för
menderas inte till barn yngre än ett år på grund av
att kunna visa om oseltamivir påverkar mortaliteten
prekliniska fynd med en kraftigt ökad koncentration
i influensa. Få patienter i de kliniska studierna hos-
av prodrogen i hjärnan och sjukdom hos unga råttor
pitaliserades, 0,7 % i oseltamivirgruppen mot 1,7 % i
jämfört med vuxna djur. Medlet utsöndras renalt var-
placebogruppen.
för dosen måste reduceras vid nedsatt njurfunktion
Gastrointestinala symtom i form av illamående,
(se produktresumé för Tamiflu www.mpa.se/human-
kräkningar, och buksmärta var i de kliniska studierna
lakemedel/humspc.shtml). Oseltamivir är godkänt
de vanligaste rapporterade biverkningarna som asso-
för behandling av influensa hos vuxna och barn äldre
cierades med oseltamivir (<10 %). Frekvensen av olika
Information från Läkemedelsverket 5:2005 15
Behandlingsrekommendation
Behandling och profylax av influensa med antivirala medel
symtom varierade något med åldern och kräkningar
extempore-beredning. För patienter som behöver styr-
var relativt sett vanligare hos barn än hos vuxna. Sä-
kan 100 mg finns licenspreparatet Symmetrel kapslar
kerhetsprofilen hos äldre patienter över 65 år liknade
100 mg. Amantadin är endast verksamt mot influen-
den hos andra grupper. I de kliniska studierna rap-
sa A. Skälet till detta är att amantadin blockerar jon-
porterades biverkningssymtomen i regel vara lindriga
kanalfunktionen av virusproteinet M2, vilket saknas
och övergående inom 1–2 dagar. Mycket sällsynta
hos influensa B. Amantadin ges oralt i dosen 100 mg
biverkningar som rapporterats efter godkännandet är
morgon och kväll. För patienter över 65 år rekom-
leverpåverkan, överkänslighetsreaktioner och allvar-
menderas generell dosreduktion till 50 mg morgon
liga hudreaktioner såsom Stevens-Johnson syndrom
och kväll för att minska centralnervösa biverkningar.
och erythema multiforme.
Till barn i åldrarna 10–13 år som väger mindre än
Mycket begränsade data finns på behandling av
40 kg doseras medlet 5 mg per kg per dag (se Ta-
patienter med allvarliga fågelinfluensainfektioner
bell I). Preparatet måste sättas in tidigt vid behand-
(H5N1). Oseltamivir har i regel satts in sent i sjuk-
ling och senast inom 48 timmar efter symtomdebut.
domsförloppet och en eventuell behandlingseffekt
I profylaxsituationen bör amantadin påbörjas före
av behandling har varit svår att utvärdera. Nyligen
förväntad smittkontakt eller snarast möjligt efter och
har dock data (opublicerade) rapporterats från Thai-
fortsätta under minst tio dagar efter exponeringen.
land som visar på en lägre dödlighet i fågelinfluensa
Resistensproblematik
(H5N1) hos patienter som fick oseltamivir tidigt
Resistens mot neuraminidashämmare har hittills på-
(inom 5 dagar efter symtomdebut) jämfört med de
visats i relativt
låg frekvens och varierar med läkeme-
som fick behandling sent (>10 dagar efter insjuk-
del och virustyp (14,15). Inga naturligt resistenta
nandet). Positiv erfarenhet av profylaktisk behand-
isolat har identifierats. På grund av den hittills be-
ling med oseltamivir mot fågelinfluensan i Holland
gränsade användningen av neuraminidashämmare
(H7N7, 2003) har också rapporterats.
är den verkliga potentialen för resistensutveckling
Amantadin (Virofral, Symmetrel)
och den kliniska betydelsen idag ofullständigt känd.
Amantadin var det första läkemedlet som blev god-
Det finns ännu inga data från kontrollerade kliniska
känt för profylax och behandling av influensa. Då
studier som belyser risken för uppkomst av korsre-
medlet saknar effekt mot influensa B, orsakar central-
sistens mellan neuraminidashämmare. Studier i cell-
nervösa biverkningar och snabbt ger resistensutveck-
kultur indikerar dock att vissa oseltamivir-resistenta
ling vid behandling har det fått mycket begränsad
virusstammar fortfarande är känsliga för zanamivir.
användning. Medlet har också ett flertal interaktioner
Resistensdata har nyligen rapporterats från Japan där
med andra läkemedel som måste beaktas.
motsvarande 5 % av befolkningen behandlades med
Amantadin har avregistrerats i Sverige och finns för
oseltamivir under säsongen 2003–2004. Vid analys
närvarande endast tillgängligt som 50 mg kapslar i
Tabell 1. Doseringsrekommendation av antivirala läkemedel för behandling och profylax
Läkemedel
Åldersgrupper (år)
1–6
7–9
10–12
13–64
>65
Zanamivir
Behandling
Ej godkänd
Ej godkänd*
Ej godkänd*
10 mg × 2
10 mg × 2
Oseltamivir
Behandling
Doserig efter / Dosering efter / Dosering efter / 75 mg × 2
75 mg × 2
kroppsvikt**
kroppsvikt**
kroppsvikt**
Profylax
Ej godkänd
Ej godkänd
Ej godkänd
75 mg × 1
75 mg × 1
Amantadin
Behandling
Ej godkänd***
Ej godkänd***
100 mg × 2**** 100 mg × 2****
50 mg × 2
100 mg × 2**** 100 mg × 2****
Profylax
Ej godkänd***
Ej godkänd***
50 mg × 2
* Behandlingsindikation för barn inte godkänd i EU. Barndosering (USA) till barn > 7 år: 10 mg × 2
**Dosrekommendation till barn baserad på kroppsvikt. Behandling med Oseltamivir.
Kroppsvikt
Rekommenderad dos för 5 dagar
< 15 kg
30 mg × 2 /dag
> 15 kg till 23 kg
45 mg × 2 /dag
> 23 kg till 40 kg
60 mg × 2 /dag
> 40 kg
75 mg × 2 /dag
*** Barndosering 1–9 år (USA): 5 mg/kg/dag upp till 150 mg/dag i två avdelade doser
**** Barn >10 år med vikt under 10 kg rekommenderas 5 mg/kg/dag i två avdelade doser
16 Information från Läkemedelsverket 5:2005
Behandlingsrekommendation
Behandling och profylax av influensa med antivirala medel
av 1 180 H3N2-isolat i samhället var 0,4% resistenta
sjukan 1918 (HIN1) (23). Oseltamivir och zanami-
mot oseltamivir och 0.1% var även korsresistenta mot
vir har i cellkultur uppvisat effekt mot H5N1, medan
zanamivir (16).
detta fågelinfluensavirus är resistent mot amantadin.
I kliniska studier sågs resistensutveckling mot osel-
Val av terapi
tamivir hos 0,3 % (4/1 177) av vuxna patienter och
Influensa är en självbegränsande sjukdom med låg
hos 4,5 % (17/374) av barnen. Högre frekvenssiff-
komplikationsrisk hos för övrigt friska ungdomar och
ror har dock rapporterats efter godkännandet och i
vuxna personer. Hos äldre och patienter med hjärt-
en nyligen publicerad japansk studie observerades att
och lungsjukdom är komplikationsrisken högre. Den
nio av 50 influensasjuka barn (18 %) behandlade med
medicinska nyttan av antiviral behandling är emel-
oseltamivir utvecklade resistens (17). För zanamivir
lertid begränsad, vilket visats i nyligen genomförda
har hittills ingen resistensutveckling dokumenterats
studier i riskpopulationer. Generell behandling kan
hos immunkompetenta patienter. Endast ett fall av
därför inte förordas. Vid svår influensa med hög feber
resistens finns rapporterat i samband med en långdra-
och påverkat allmäntillstånd bör dock terapi övervä-
gen influensa B infektion hos ett immunsupprimerat
gas (se Faktaruta 4). Specifika studier som dimen-
barn (18). Kunskap saknas om sekundärspridning av
sionerats för att utvärdera effekten av antiviral terapi
resistenta virusvarianter kan inträffa, men data talar
på komplikationer och mortalitet har emellertid inte
för att neuraminidasmutationer medför nedsatt vi-
utförts.
rulens och replikationsförmåga. I en djurmodell har
Om indikation för behandling av influensa bedöms
dock transmission av oseltamivirresistenta varianter
föreligga rekommenderas i första hand neuraminidas-
till andra djur i omgivningen dokumenterats (19).
hämmare. Zanamivir förordas framför oseltamivir vid
Resistensutveckling mot amantadin är vanlig vid
influensa B-epidemier. Det är oklart om
amantadin
behandling och uppträder snabbt hos cirka 30 % av
för närvarande har någon plats vid behandling av in-
patienterna. Ingen resistensutveckling har dock rap-
fluensa.
Orsaker till detta är medlets brist på effekt på
porterats när medlet används enbart för profylax.
influensa B, dess interaktions- och biverkningsprofil
Ingen korsresistens föreligger mellan neuraminidas-
med framför allt centralnervösa biverkningar och den
hämmare och amantadin.
snabba resistensutvecklingen. I profylaxsituationer
Nyligen visades i en global övervakningsstudie
kan dock medlet komma till användning.
innefattande över 7 000 influensa A-isolat att resis-
Vid ordination av zanamivir är det förskrivarens
tens mot amantadin/rimantadin ökat signifikant från
ansvar att patienten får noggranna instruktioner om
0,4 % år 1994−1995 till 12,3 % år 2003−2004 (19B).
inhalationsteknik och hur diskhalern ska användas.
Ökningen var mest markant i Asien med de högsta
Vid lindrig till måttlig astma och kroniskt obstruktiv
frekvenssiffrorna i Kina (74 %), men en liknande
lungsjukdom bör zanamivir användas med försiktig-
trend observerades också i USA under de första sex
het och bronkdilaterande medicinering bör alltid ad-
månaderna av influensasäsongen 2005 med en inci-
ministreras före inhalation av zanamivir. Hos patien-
densökning av amantadinresistens från 2 % till 15 %.
ter med en svår astma i samband med influensa bör
Influensapandemi
zanamivir inte användas.
Det finns idag ingen dokumentation om resistensut-
Neuraminidashämmare bör tills vidare undvikas
veckling vid utbredd användning av antivirala läke-
under graviditet. Djurstudier indikerar inga direkta
medel under pandemiska förhållanden. I cellkultur
eller indirekta skadliga effekter på graviditet eller fos-
och i djurmodeller har det visats att befintliga influ-
ter, men relevant dokumentation från användning av
ensaläkemedel har effekt mot utvalda fågelinfluen-
neuraminidashämmare hos gravida kvinnor saknas.
savirus isolat (20–22). Neuraminidashämmarna och
Barn äldre än ett år kan behandlas med oseltamivir,
amantadin har också visats vara aktiva mot de virus
som doseras efter kroppsvikt. Zanamivir är inte god-
som orsakade pandemier år 1957 (H2N2) och 1968
känt för behandling av barn yngre än tolv år i Europa.
(H3N2), samt mot ett influensavirus som framställts
För amantadin är åldersgränsen i Sverige tio år.
med genteknologi, innehållande hemagglutinin och
Dokumentation saknas rörande behandlingseffekt
neuraminidas från det virus som orsakade Spanska
och säkerhet för immunsupprimerade patienter. Då
Faktaruta 4.
Generella rekommendationer för behandling av misstänkt influensa med antiviral terapi
Patientgrupper där antiviral terapi bör övervägas:
• Influensa som kräver sjukhusvård
• Medicinska riskgrupper med risk för komplicerat förlopp.
Förutsättningar som måste vara uppfyllda:
• Lokal influensaepidemi som är virologiskt verifierad
• Symtombild talande för influensa
• Annan allvarlig infektion utesluten
• Behandlingsstart möjlig tidigt i förloppet, senast 48 timmar efter symtomdebut
Information från Läkemedelsverket 5:2005 17
Behandlingsrekommendation
Behandling och profylax av influensa med antivirala medel
det sannolikt föreligger högre virusnivåer samt längre
rad influensa varierade från 60 % till 83 % i de olika
duration av virusutsöndring i denna patientgrupp be-
studierna. En ny ansökan om godkännande inom EU
döms att den potentiella behandlingsvinsten skulle
utvärderas för närvarande.
kunna vara större än för andra grupper. I sådana fall
Oseltamivir (Tamiflu)
kan det finnas skäl att sätta in behandling även senare
Oseltamivirs preventiva effekt mot influensa har ut-
än 48 timmar efter symtomdebut eftersom biverk-
värderats i en studie av post-expositionsprofylax i
ningsrisken är låg.
familjehushåll (n=962) och i tre studier av säsongs-
Praktisk handläggning
profylax i samhället (n=2 134). Endast vuxna och
Vid telefonkontakt bör patienten utfrågas grundligt
ungdomar äldre än tolv år inkluderades i studierna.
om kliniska symtom och epidemiologi inkluderande
Det primära effektmåttet var incidensen av laborato-
reseanamnes avseende områden med pågående in-
rieverifierad klinisk influensa.
fluensaepidemi (se Faktaruta 2). Om patienten för
Skyddseffekten av sju dagars oseltamivirprofylax,
övrigt är frisk och har typisk anamnes/epidemiologi
i dosen 75 mg × 1 insatt inom 48 timmar efter ex-
för influensa rekommenderas i första hand symtoma-
ponering för influensasmitta i familjehushåll, upp-
tisk behandling. I tveksamma fall rekommenderas
mättes till 92 % (95 % KI 72–98) i populationen där
förnyad telefonkontakt efter några timmar. Patienter
indexfallet hade en verifierad influensa och till 89 %
med påtaglig allmänpåverkan bör undersökas kliniskt
(95 % KI 72–96) i ITT-populationen. Incidensen av
för säker differentialdiagnostik och ställningstagande
influensa var 24/200 (12 %) i placebogruppen och
till eventuell antiviral terapi. Vid försämrat allmäntill-
2/205 (1 %) i oseltamivirgruppen i den första po-
stånd eller om hög feber kvarstår längre än förväntat
pulationen. Motsvarande siffror för ITT var 34/462
måste annan diagnos eller komplikation misstänkas.
(7 %) respektive 4/493 (1 %). Således var antalet som
Andra behandlingskrävande allvarliga infektioner så-
behövde behandlas för att förhindra ett fall av influ-
som bakteriell pneumoni och sepsis bör övervägas.
ensa (Number Needed to Treat; NNT) nio respek-
I öppen vård behövs ej virologisk diagnostik innan
tive 16 i de olika populationerna.
antiviral behandling påbörjas. Om det finns någon
I de tre samhällsstudierna, varav två hos friska
tveksamhet om diagnosen hos svårt sjuka patienter
vuxna med identisk design (poolad analys)
och en
med hög feber och påverkat allmäntillstånd bör viro-
hos äldre individer >65 år, gavs oseltamivir under sex
logisk diagnostik utföras och, om patienten läggs in
veckor som säsongsprofylax mot influensa i samhäl-
på sjukhus, av nosokomiala skäl. Varken neuramini-
let. Incidensen av klinisk influensa reducerades i den
dashämmare eller amantadin skall sättas in om mer än
poolade analysen från 25/519 (4,8 %) i placebogrup-
48 timmar förflutit sedan symtomdebut med undan-
pen till 6/520 (1,2 %) i oseltamivirgruppen (76 %;
tag för immunsupprimerade patienter. Patienten bör
95 % KI 42–90). Motsvarande reduktion i äldrestu-
också tillrådas att ta förnyad kontakt med sjukvården
dien var 12/272 (4,4 %) till 1/276 (0,4 %) (92 %;
vid misstänkta biverkningar. Rutinmässig uppföljning
95 % KI 37–99). I subgruppen av äldre som hade
är för övrigt ej nödvändig. Behandling av sekundär-
vaccinerats uppmättes skyddseffekten till 91 %. NNT
infektioner sker enligt sedvanliga rutiner. Till alla pa-
var 28 i vuxenstudien och 25 i äldrestudien.
tienter, även till dem som behandlas med antivirala
Den profylaktiska skyddseffekten mot influensa B
läkemedel, kan sedvanlig symtomatisk behandling
beräknades till 78 % i familjestudien. Övriga profylax-
rekommenderas.
studier inkluderade för få fall för att tillåta någon säker
Profylax av influensa med antivirala medel
slutsats om effekten mot influensa B. Inga specifika
säkerhetsrisker identifierades i profylaxstudierna, och
Den viktigaste profylaktiska åtgärden för att begränsa
oseltamivir tolererades i allmänhet väl. Illamående
de medicinska konsekvenserna av influensa är årlig
förekom oftare hos de behandlade jämfört med pla-
vaccination av de medicinska riskgrupperna, god
cebo, medan huvudvärk, som var det vanligaste sym-
handhygien och undvikande av närkontakt med in-
tomet, förekom i samma frekvens i båda grupperna.
fluensasjuka individer. Antivirala substanser kan vara
Amantadin (Virofral, Symmetrel)
ett komplement, men ersätter inte vaccination.
Studier med amantadin och rimantadin som profylax
Val av läkemedel
mot influensa A har visat på en ca 70–90 % skyddsef-
Endast oseltamivir är för närvarande godkänt för pro-
fekt mot samhällsförvärvad influensa och vid smitta
fylax mot både influensa A och B hos vuxna och ung-
inom hushåll och inom olika sjukvårdsinrättningar.
domar från 13 års ålder i dosen 75 mg × 1. Amantadin
Den rekommenderade profylaxdosen för amantadin
är verksamt mot influensa A, men finns numera bara
är 100 mg × 2 för åldrarna 10–65 år och 50 mg × 2
tillgängligt som
extempore-beredning eller på licens.
för personer äldre än 65 år. Till barn i åldrarna över
Zanamivir i dosen 2 inhalationer en gång dagligen
10 år och som väger mindre än 40 kg doseras medlet
har studerats på profylaxindikationen mot influensa A
5 mg/kg/dag. Amantadin är numera avregistrerat i
och B, både avseende säsongsprofylax (4 veckor) och
Sverige men kan fås som
extempore-beredning eller
post-expositionsprofylax (10 dagar) i familjehushåll.
på licens (se ovan).
Skyddseffekten mot symtomatisk laboratorieverifie-
Om indikation för profylaxbehandling bedöms
18 Information från Läkemedelsverket 5:2005
Behandlingsrekommendation
Behandling och profylax av influensa med antivirala medel
föreligga rekommenderas i första hand oseltamivir
Influensautbrott på särskilda boenden och sjukhus
eftersom amantadin saknar effekt mot influensa B
• Vid misstänkt nosokomialt influensautbrott på
och kan orsaka centralnervösa biverkningar framför
sjukhus och i särskilda boenden för äldre patienter
allt hos äldre. Studier med amantadin har visat att
rekommenderas virologisk diagnostik på indexfal-
denna profylax blir ineffektiv om man samtidigt an-
let för att verifiera och typbestämma stammen.
vänder medlet för behandling, eftersom resistens då
Amantadin har i studier visat en skyddseffekt på
snabbt kan uppkomma hos de behandlade patienter-
60–90 % vid nosokomiala influensa A-utbrott.
na. Spridning av resistenta stammar från behandlade
Motsvarande data saknas för oseltamivir, men i
sjuka till personer som får profylax gör att man inte
andra profylaxsituationer har medlet visat sig vara
får någon skyddseffekt.
minst lika effektivt som amantadin. Oseltamivir
Indikationer
kan därför övervägas i dessa situationer och även
Den viktigaste målgruppen för antiviral profylax är
vid nosokomial influensa B-smitta. Vid etablerat
de medicinska riskgrupperna. Indikationen för
att
influensautbrott rekommenderas efter individuell
ge
profylax med antivirala medel bör bedömas från
bedömning profylax med oseltamivir och vacci-
fall till fall beroende på omständigheter och popu-
nation. Om antiviral profylax ges, bör den helst
lation som behöver skyddas. I speciella situationer
ges till alla, oberoende av vaccinationsstatus, och
kan profylax med antivirala medel vara viktigt för
fortgå upp till 14 dagar eller till cirka sju dagar
många inom riskgrupperna, såsom vid dålig överens-
efter det att det sista konfirmerade fallet av in-
stämmelse mellan epidemistammen och vaccinstam-
fluensa inträffat. Andra viktiga åtgärder för att
marna, vilket resulterar i ett inkomplett vaccinskydd,
minska smittspridningen inbegriper isolering av
samt i en pandemisituation. Övriga indikationer kan
sjuka patienter, begränsning av antalet besökare,
vara influensautbrott på sjukhus, sjukhem eller andra
skärpta hygienrutiner och sjukskrivning av perso-
institutioner, eller influensainsjuknande hos vårdare/
nal med symtom.
familjekontakt till patient i medicinska riskgrupper.
• Vid risk för sekundärsmitta på sjukhus hos patien-
Nedan följer beskrivning av speciella situationer där
ter som sannolikt blivit utsatta för influensa av
profylax med antivirala medel bör övervägas.
medpatient/personal bör antiviral profylax erbju-
das. Vid fall av influensa på högriskavdelningar på
Influensa i samhället – medicinska
sjukhus som t.ex. transplantationsavdelningar kan
riskgrupper
profylax till alla patienter bli aktuell.
• För individer som tillhör en medicinsk riskgrupp
Utlandsresenärer
är vaccination förstahandsval. Om vaccinationen
Vid resor till länder med pågående influensautbrott
sker sent och en influensaepidemi redan startat
(notera att influensasäsongen infaller under olika tid
kan antiviral profylax ges under perioden innan
över världen) bör vaccination övervägas. I länder där
optimal skyddseffekt förväntats ha uppnåtts, dvs.
WHO bedömt att det föreligger ett överhängande hot
under 10–14 dagar efter vaccinationstillfället.
för en pandemi bör aktuella reserekommendationer
• Individer som tillhör medicinska riskgrupper och
avseende influensaprevention från berörda myndig-
av olika skäl inte kan vaccineras, och individer
heter och organisationerbeaktas (www.who.int, www.
med nedsatt immunförsvar med förväntad låg/
socialstyrelsen.se, www.smittskyddsinstitutet.se).
ingen skyddseffekt av vaccinet rekommenderas i
Barn
första hand försiktighetsåtgärder såsom att und-
Det vore önskvärt att även kunna ge profylax till barn
vika folksamlingar och kontakt med infekterade
i riskgrupperna, när dessa inte skyddats mot influensa
individer samt noggrann handtvätt. I vissa hög-
genom vaccination, men dokumentation saknas. Pro-
risksituationer kan dock såväl korttids- som sä-
fylaxindikationen för barn är under utvärdering. I av-
songsprofylax vara indicerad.
vaktan på detta får man i varje enskilt fall överväga
• Mer generell profylax kan bli aktuell om vaccinet
om barn med svåra underliggande sjukdomar skall
inte stämmer överens med den influensastam som
ges profylax med antivirala medel.
orsakar epidemin, vid en eventuell vaccinbrist och
i en pandemisk situation
Användning av antivirala läkemedel
Influensa inom hushåll med individ som tillhör
under en influensapandemi
medicinska riskgrupper
Vaccin är hörnstenen i preventionsstrategin mot in-
• Vid influensasmitta i en familj där någon tillhör
fluensasjukdomens skadeverkningar. I händelse av en
de medicinska riskgrupperna, bör antiviral profy-
pandemi kan en initial vaccinbrist förutses och i detta
lax ges till riskpatienten oavsett vaccinationsstatus,
läge kommer antivirala läkemedel att vara den enda
och i särskilda fall till alla inom hushållet, under
specifika motåtgärden mot influensan. Neuramini-
minst sju dagar eller tills utbrottet i familjen är
dashämmare är aktiva i cellkultur mot alla subtyper av
över. Profylaxen bör insättas så snart som möjligt
influensa A, men har inte prövats kliniskt i kontrolle-
och senast inom 48 timmar från misstänkt smit-
rade studier varken för behandling eller profylax mot
totillfälle.
andra stammar än de som cirkulerar för närvarande.
Information från Läkemedelsverket 5:2005 19
Behandlingsrekommendation
Behandling och profylax av influensa med antivirala medel
Läkemedlen interfererar inte med immunsvaret på
Behandling
inaktiverade vacciner.
Profylax är det bästa sättet att förhindra sjukdom och
Amantadin användes som säsongsprofylax un-
smittspridning, men kräver tillgång till ett omfattande
der Hongkonginfluensan 1968, och visades ha en
beredskapslager. Långtidsprofylax rekommenderas i
skyddseffekt på 60–70 %. Erfarenhet av neuramini-
den svenska pandemiplanen till personer med viktiga
dashämmare i en pandemisituation saknas helt, men
samhällsfunktioner och riktad korttidsprofylax till ak-
det kan antas att också dessa medel skulle vara ef-
tuella medicinska riskgrupper.
fektiva. Begränsningar med läkemedlen är att de för
Antiviral behandling kan vara till nytta för indivi-
behandling måste sättas in tidigt i sjukdomsförloppet
den, men har begränsad effekt på epidemin. Dessut-
(senast inom 48 timmar efter symtomdebut) för att
om kan det vara svårt att komma in tillräckligt tidigt
ha effekt och att de för profylax måste ges under hela
i sjukdomsförloppet och vinsten med behandling är
perioden när risk för influensaexposition finns (minst
begränsad baserad på de data som finns i de kliniska
sex veckor) eller innan skydd av vaccinet hunnit ut-
studierna utförda under de årligen återkommande in-
vecklats (cirka två veckor). Exponerade personer kan
fluensautbrotten. Antiviral behandling bör reserveras
få subklinisk infektion med utveckling av antikropps-
för fall med svår influensasjukdom och för grupper
svar trots antiviral profylax. Skyddseffekten av den
som riskerar allvarliga komplikationer, medan gene-
subkliniska infektionen är dock inte undersökt.
rell behandling av lindriga fall inte är indicerad.
Beredskapslagring av läkemedlen ingår i den natio-
Specifika rekommendationer för användning av
nella pandemiplanen (www.socialstyrelsen.se/NR/
antivirala läkemedel kommer att utfärdas i samband
rdonlyres/9827867F-6CB7-40D0-BE97-408826C
med att en pandemi uppträder, och är beroende av
1CB9D/3086/20051301.pdf), men lagren kommer
aktuell kunskap om vilka som kommer att drabbas
inte att räcka till hela befolkningen. Antiviral behand-
hårdast av infektionen samt vilken omfattning pan-
ling/profylax bör i första hand reserveras för priori-
demin beräknas få i Sverige. För att förhindra eller
terade riskgrupper enligt pandemiplanen. Risken för
fördröja en pandemi kan behandling och profylax i
resistensutveckling, hur snabbt sådan kan uppkomma
ett område där ett potentiellt pandemiskt virus först
och om resistenta virusvarianter har kapacitet till se-
upptäcks vara en effektiv åtgärd (24,25). WHO har
kundärspridning är osäkerhetsfaktorer vid utbredd
rekommenderat att ett internationellt beredskapsla-
behandling med antivirala medel. Internationella
ger upprättas för detta ändamål.
nätverk övervakar kontinuerligt resistensutveckling
Referenser
mot neuraminidashämmare. Övervakningen måste
1.
Brown F, Robertson JF, Schild GC, Wood JM (eds): Inactivated
intensifieras i en pandemisituation.
influenza vaccines prepared in cel culture. Dev Biol Stand. Basel
Neuraminidashämmare bedöms vara de läkeme-
Karger 1999, vol 98.
del som bäst lämpar sig för massanvändning under
2.
www.fda.gov/cber/products/inflmed061703.htm
3.
Voordouw A, Sturkenboom M, Dieleman JP,et al. Annual revac-
en pandemi på grund av sin mer fördelaktiga bi-
cination against influenza and mortality risk in community-dwel-
verknings-, interaktions- och resistensprofil. Aman-
ling elderly persons. JAMA 2004;292;2089–95.
tadin kan dock komma till användning för profylax
3B. Jefferson T, Rivetti D, Rivetti A et al. Efficacy and effectiveness of
till tidigare friska vuxna och ungdomar, förutsatt att
influenza vaccines in elderly people: a systematic review. Lancet,
published online 22 September, 2005.
cirkulerande pandemivirus är känsligt för medlet.
4.
Potter J, Stott DJ, Roberts M et al. Influenza vaccination of health
Av neuraminidashämmarna har oseltamivir fördelar
care workers in long-term hospitals reduces the mortality of eld-
framför zanamivir vad gäller administrationsväg. Det
erly patients. J Infect Dis 1997;175:1–6.
är dessutom dokumenterat i alla åldersgrupper och
5.
Carman WF, Elder AG, Wal ace LA et al. Effects of influenza
vaccination of health-care personnel on mortality of elderly pe-
kan ges till barn ner till ett års ålder. Oseltamivir be-
ople in long-term care: a randomised trial control ed trial. Lancet
döms således vara förstahandsmedel. Zanamivir kan
2000;355:93–7.
dock ha en plats med tanke på att neuraminidashäm-
6.
Poland GA, Tosh P, Jacobson RM. Requiring influenza vaccina-
marna skiljer sig något åt vad gäller benägenhet för
tion for health care workers: seven truths we must accept. Vaccine
2005;23:2251–5.
resistensutveckling och resistensprofiler. Amantadin
7.
Prevention and control of Influenza. MMWR 2005;54(RR08):1-
har fördelen att vara billigare och ha längre hållbar-
40.
het vid lagring än neuraminidashämmarna. Oseltami-
8.
Shahab SZ, Glezen WP. Influenza virus. In: Gonik B, ed. Viral di-
vir finns dock tillgängligt i en bulkpreparation med
seases in pregnancy. New York, NY: Springer-Verlag; 1994:215–
23.
längre hållbarhet (cirka 10 år).
9.
Irving WL, James DK, Stephenson T, et al. Influenza vi-
Hur antivirala läkemedel optimalt ska användas
rus infection in the second and third trimesters of preg-
under en pandemi är idag oklart.
nancy: a clinical and seroepidemiological study. BJOG
Tänkbara användningsområden:
2000;107:1282–9.
10. Neuzil KM, Reed GW, Mitchel EF et al. Impact of influenza
Profylax
on acute cardiopulmonary hospitalizations in pregnant wo-
• korttidsprofylax efter exposition
men, Am J Epidemiol 1998;148:1094–102.
• långtidsprofylax under hela säsongen.
11. Hien TT, Liem NT, Dung TD et al. Avian influenza A
(H5N1) in 10 patients in Vietnam. New Engl J Med
2004;350:1179–88.
20 Information från Läkemedelsverket 5:2005
Behandlingsrekommendation
Behandling och profylax av influensa med antivirala medel
12. de Jong MD, Cam BV, Qui PT et al. Fatal avian influenza
19B. Bright RA, Medina M, Xu X et al. Incidence of adaman-
A (H5N1) in a child presenting with diarrhea followed by
tane resistance among influenza A (H3N2) viruses isolated
coma. New Engl J Med 2005;352:686–91.
worldwide from 1995 to 2005: a cause of concern. Lancet
13. Fouchier R, Schneeberg PM, Rozendaal et al. Avian influ-
,published online 22 September, 2005.
enza A virus (H7N7) associated with human conjunctivi-
20. Gorkova EA, Leneva IA, Goloubeva OG et al. Comparisons
tis and a fatal case of respiratory distress syndrome PNAS
of RWJ-270201, zanamivir and oselatmivir agaisnt H5N1,
2004;101:1356–61.
H9N2 and other avian influenza viruses. Antimirob Agents
14. McKimm-Bresckin JL. Resistance of influenza viruses to
and Chemother 2001;45:2723–32.
neuraminidase inhibitors: a review. Antiviral Res 2000;47:1–
21. Leneva IA, Golubeva O, Fenton RJ et al. Efficacy of za-
17.
namivir against avian influenza A viruses that possess ge-
15. Gubareva LV. Molecular mechanisms of influenza virus resis-
nes encoding H5N1 internal proteins and are patho-
tance to neuraminidase inhibitors. Virus Res 2004;103:199–
genic in mammals. Antimirob Agents and Chemother
203.
2001;45:1216–24.
16. Use of influenza antivirals during 2003-2004 and monito-
22. Leneva IA, Roberst N, Govorka EA et al. The neuramini-
ring of neuraminidase inhibitor resistance. Weekly Epide-
dase inhibitor GS4104 (oselatmivir phosphate) is efficacious
miological record 2005;17:156.
ad against A/Hong Kong/156/97 (H5N1) and A/Hong
17. Kiso M, Mitamura K, Sakai-Tagawa K et al. Resistant influ-
Kong/1074/99 (H9N2) influenza viruses. Antiviral Res
enza A viruses in children treated with oseltamivir: descrip-
2000;248:101–15.
tive study. Lancet 2004;364:759–65.
23. Tumpey TM, Garcia-Sastre A, Mikulasova A et al. Existing
18. Gubareva LV, Matrosovichi MN, Brenner MK et al. Evidence
antivirals are effective aginst influenza viruses with genes
for zanamivir resistance in an immunocompromised child in-
from the 1918 pandemic virus. PNAS 2002: 99:13849–
fected with influenza B virus. J Infect Dis 1998;178:1257–
54.
62.
24. Longini IM, Nizam A, Shufu S et al Containing pandemic
19. Herlocher ML, Truscon R, Elias S et al. Influenza viruses
influenza at the source, Science 2005;309:1083–7.
resistant to the antiviral drug oseltamivir: transmission stu-
25. Ferguson NM, Cummings D, Cauchemez S et al. Strategies
dies in ferret. J Infect Dis 2004;190:1627–30.
for containing an emerging influenza pandemic in Southeast
Asia. Nature 2005;437:209–14.
Deltagarlista
Deltagarnas jävsdeklarationer kan erhållas från Läkemedelsverket.
Med dr/distr läk Johan Berglund
Smittskyddsläkare Anders Lindberg
Ronneby läkarstation
Smittskyddsenheten Halland
Rosengatan 15
Länssjukhuset
370 30 Ronneby
301 85 Halmstad
Assistent Kristina Bergström
Professor Annika Linde
Läkemedelsverket
Smittskyddsinstitutet
Box 26
171 82 Solna
751 03 Uppsala
Med dr Anders Tegnell
Docent Mia Brytting
Socialstyrelsen
Avd för virologi
106 30 Stockholm
Smittskyddsinstitutet
171 82 Solna
Dr Ingrid Trolin
Läkemedelsverket
Professor Leif Gothefors
Box 26
Barn- och ungdomsmed
751 03 Uppsala
Norrlands univ sjukhus
901 85 Umeå
Professor Ingrid Uhnoo
Läkemedelsverket
Överläkare Kristina Jarl
Box 26
Brommageriatriken AB
751 03 Uppsala
Bromma sjukhus
Box 3084
Smittskyddsläkare Per-Erik Åbom
161 03 Bromma
Enheten för smittskydd/Vårdhyg
Länssjukhuset
551 85 Jönköping
Information från Läkemedelsverket 5:2005 21
Behandlingsrekommendation
Behandling och profylax av influensa med antivirala medel
ADDENDUM
Faktaruta. EU kriterier för influensa
Inom EU pågår ett arbete att få data om rapporterade smittsamma sjukdomar mer jämförbara mellan olika
länder. Som en del i detta har falldefinitioner för ett 40-tal sjukdomar tagits fram och nedan följer den för
influensa. Den är ämnad att användas som kriterium för vilka fall som ska rapporteras och inte att användas
som en del av diagnostiken av enskilda fall.
Allmänna principer för tillämpning av falldefinitionerna
• Om inte annat anges skall endast symtomgivande fall rapporteras. Asymtomatiska infektioner skall emel-
lertid betraktas som fall om infektionen kan komma att kräva behandling eller om den har konsekvenser
för folkhälsan.
• Ett ”fall med epidemiologiskt samband” är ett fall som antingen har exponerats för ett bekräftat fall el-
ler som utsatts för samma exponering som ett bekräftat fall (t.ex. ätit av samma livsmedel eller vistats på
samma hotell).
• Ett system med tre nivåer enligt nedan skall användas:
Bekräftat fall: laboratorieverifierat.
Troligt fall: kliniskt tydlig bild eller epidemiologiskt samband till bekräftat fall.
Möjligt fall: kliniskt möjlig bild, utan att vara bekräftat eller troligt fall.
Klassificeringen av de olika nivåerna kan variera beroende på de enskilda sjukdomarnas epidemiologi.
• De kliniska symtomen i förteckningen är endast exempel på symtom, förteckningen är inte uttömmande.
• För de flesta sjukdomarna anges flera ”kriterier för laboratorieanalys”. Om inte annat anges behöver endast
ett av dessa kriterier uppfyllas för att fallet skall anses vara bekräftat.
• I.T. i förteckningen över falldefinitioner betyder ”inte tillämpligt”.
Inledande anmärkningar
(1) Informationen i detta dokument är endast avsedd för enhetlig rapportering/jämförbarhet av uppgifter
inom gemenskapsnätverket.
De kliniska beskrivningarna anger de allmänna dragen hos sjukdomarna men rymmer inte nödvändigtvis alla
erforderliga särdrag för en klinisk diagnos av dessa.
(2) De laboratoriekriterier för diagnos som anges kan uppfyllas med olika testmetoder. Där specifika metoder
anges, rekommenderas dock dessa.
Influensa
Klinisk beskrivning
Klinisk bild förenlig med influensa, t.ex. plötslig sjukdomsdebut, hosta, feber > 38ºC, muskel- och/eller
huvudvärk.
Laboratoriekriterier för diagnos
• Påvisande av antikroppar mot influensa eller influensavirusspecifikt RNA.
• Isolering av influensavirus.
• Påvisande av specifik antikroppsreaktion mot influensa A eller B.
Fallklassificering
Möjligt: Ett med kliniken förenligt fall med epidemiologiskt samband.
Troligt: I.T.
Bekräftat: Ett kliniskt fall som är laboratorieverifierat.
22 Information från Läkemedelsverket 5:2005
Farmakologisk behandling av depression
hos barn och ungdomar – en uppdatering av
kunskapsläget
– Behandlingsrekommendation
Depression hos barn och ungdomar är ett allvarligt tillstånd med förhöjd risk för för tidig död, framtida psykisk och
fysisk ohälsa samt sociala anpassningssvårigheter. Behandlingen är omdiskuterad. Särskilt gäller detta läkemedlens
roll. Inga antidepressiva läkemedel är godkända för behandling av depression hos barn och ungdomar i Europa.
Det är också väl känt att farmakologisk behandling av barn ibland bedöms vara nödvändig och att antidepressiva
läkemedel därför används. Mot bakgrund av rapporter om biverkningar i form av emotionell labilitet, självskador
och självmordstankar/självmordsförsök samt utsättningsreaktioner har särskilt SSRI:s plats i terapin diskuterats.
Önskemål om vägledning har framförts från professionen. I ljuset av detta har Läkemedelsverket valt att ge en
uppdatering av kunskapsläget och anordnade därför ett expertmöte den 3 maj 2005. Faktauppgifterna baseras
på SBU-rapporten ”Behandling av depressionssjukdomar – en systematisk litteraturöversikt”. Särskilt gäller detta
avsnitten om icke-farmakologisk behandling och sjukdomsförekomst medan avsnitten som rör läkemedelsbehandling
har uppdaterats (se bakgrundsdokumentation). Texten nedan är förankrad hos Svenska föreningen för barn- och
ungdomspsykiatri.
Epidemiologi
Prevalensen av egentlig depression hos tonåringar
bedömas och somatiska bakgrundsfaktorer värderas.
uppges vara 5–6 % och hos barn i förskole- och skol-
Vid depressionstillstånd i barn- och ungdoms-
åldern knappt 1 %. Inga säkra data finns huruvida in-
åren kan ospecifika symtom vara mer framträdande
cidensen av egentlig depression har förändrats över
än specifika depressionssymtom såsom nedstämdhet.
tid. Före puberteten förekommer depression i lika
Nästan alla förskolebarn med depression klagar över
stor omfattning hos pojkar som hos flickor. Från pu-
kroppsliga symtom, t.ex. smärtor, medan hälften
bertetens början dominerar flickorna.
av tonåringarna anger sådana symtom. Huvudvärk,
mag- och bröstsmärtor är vanligt förekommande.
Definition och diagnos
Ängslan, mörkerrädsla, irritation, olustkänslor och
Sorgsenhet och förstämning är inte ovanliga symtom
separationsångest är exempel på psykiska symtom
hos barn och ungdomar och övergången till depressi-
som förekommer hos barn med depression.
on kan vara flytande. Då diagnosen ofta kan vara svår
Depressiva tillstånd kan finnas inom många barn-
att ställa är det viktigt att som hjälpmedel utnyttja de
och ungdomspsykiatriska problemområden. Innan
diagnostiska system som finns tillgängliga.
man fastställer diagnosen egentlig depression bör dif-
Det finns flera olika diagnostiska system för de-
ferentialdiagnoser som till exempel bipolär sjukdom
pression. I kliniska studier används också flera olika
beaktas.
skattningsskalor för att definiera depressionsbegrep-
Det är vanligt med psykisk samsjuklighet vid
pet och för att beskriva depressionens svårighetsgrad.
egentlig depression, vilket påverkar diagnostik och
Det diagnostiska system, som i regel används för di-
behandlingsinriktning.
agnostik av egentlig depression eller annan diagnos
Skattningsskalor
inom gruppen ”förstämningssyndrom” är DSM-IV
(APA 1995) (Faktaruta 1). I kliniska studier hänvisas
Det finns ett mycket stort antal skattningsskalor, hu-
ofta till WHO:s ICD-10 (Faktaruta 2), där definitio-
vudsakligen av två typer; intervjubaserade skalor och
ner för lindrig, måttlig och svår egentlig depression
självskattningsskalor (se Faktaruta 3). Skattnings-
ges. Båda har modifierats till det som är specifikt för
skalorna är utformade för olika åldersgrupper. Vissa
barn och ungdomar.
skattningsskalor används huvudsakligen i kliniska
Bedömning och diagnostik av barn och ungdomar
studier medan andra skalor med fördel kan användas
med misstänkt depression skall alltid grundas på en
som komplement vid diagnostik och utvärdering av
noggrann anamnes samt en omsorgsfull klinisk be-
behandlingsresultatet i klinisk praxis. Skattningsska-
dömning och undersökning. Det är en fördel om in-
lor kan även vara till hjälp i dialogen med patient och
formation kan fås från såväl barnet/den unga själv
anhöriga.
som närstående och skolpersonal. Ibland ger de olika
information, som då måste vägas ihop till en samlad
klinisk bedömning. Sjukdomens svårighetsgrad skall
Information från Läkemedelsverket 5:2005 23
Behandlingsrekommendation
Farmakologisk behandling av depression hos barn och ungdomar
Faktaruta 1. Diagnoskriterier enligt DSM-IV
Egentlig depressionsepisod
A. Minst fem av följande symtom har förekommit under samma tvåveckorsperiod. Detta har inneburit en förändring av
personens tillstånd. Minst ett av symtomen (1) nedstämdhet eller (2) minskat intresse eller glädje måste föreligga.
Obs: Inkludera ej symtom som uppenbart beror på somatisk sjukdom/skada eller på stämningsinkongruenta
vanföreställningar eller hallucinationer.
(1) Nedstämdhet under större delen av dagen, så gott som dagligen, vilket bekräftas antingen av personen själv (t.ex.
känner sig ledsen eller t.o.m.) eller av andra (t.ex. ser ut att vilja gråta). Obs: Hos barn och ungdomar kan irritabilitet
förekomma.
(2) Klart minskat intresse för eller minskad glädje av alla eller nästan alla aktiviteter under större delen av dagen, så gott
som dagligen (vilket bekräftas antingen av personen själv eller av andra).
(3) Betydande viktnedgång (utan att avsiktligt banta) eller viktuppgång (t.ex. mer än femprocentig förändring av kropps-
vikten under en månad), eller minskad alternativt ökad aptit nästan dagligen. Obs: Ta också med i beräkningen om
förväntad viktökning hos barn uteblivit.
(4) Sömnstörning (för lite eller för mycket sömn nästan varje natt).
(5) Psykomotorisk agitation eller hämning så gott som dagligen (observerbar för omgivningen och inte enbart en sub-
jektiv upplevelse av rastlöshet eller tröghet).
(6) Svaghetskänsla eller brist på energi så gott som dagligen.
(7) Känslor av värdelöshet eller överdrivna eller obefogade skuldkänslor (vilka kan ha vanföreställningskaraktär) nästan
dagligen (inte enbart självförebråelser eller skuldkänslor över att vara sjuk).
(8) Minskad tanke- eller koncentrationsförmåga eller obeslutsamhet så gott som dagligen (vilket bekräftas antingen av
personen själv eller av andra).
(9) Återkommande tankar på döden (inte enbart rädsla för att dö), återkommande självmordstankar utan någon särskild
plan, gjort självmordsförsök eller har planerat för självmord.
B. Symtomen uppfyller inte kriterierna för blandepisod mani/depression.
C. Symtomen orsakar kliniskt signifikant lidande eller försämrad funktion i arbete, socialt eller i andra viktiga avseen-
den.
D. Symtomen beror inte på direkta fysiologiska effekter av någon substans (t.ex. missbruksdrog, medicinering) eller av
somatisk sjukdom/skada (t.ex. hypotyroidism).
E. Symtomen förklaras inte bättre med sorgereaktion, dvs. den depressiva symtomatologin har varat längre än två
månader efter en närståendes bortgång eller karaktäriseras av påtaglig funktionsförsämring, sjuklig upptagenhet av
känslor av värdelöshet, självmordstankar, psykotiska symtom eller psykomotorisk hämning.
Dystymi (300.4)
A. Nedstämd större delen av dagen flertalet dagar under minst två år vilket bekräftas antingen av personen själv eller av
andra.
Obs: Hos barn och ungdomar kan sinnesstämningen även vara irritabel, och varaktigheten måste vara minst ett år.
B. Minst två av följande symtom förekommer vid nedstämdhet:
(1) minskad aptit eller äter för mycket
(2) för lite eller för mycket sömn
(3) brist på energi eller svaghetskänsla
(4) nedvärderar sig själv
(5) koncentrationssvårigheter eller obeslutsamhet
(6) hopplöshetskänslor
C. Under tvåårsperioden (ett år hos barn och ungdomar) har personen inte varit besvärsfri, dvs. utan symtom enligt
kriterium A och B, under längre period än två månader åt gången.
D. Någon egentlig depressionsperiod (se ovan) har inte förekommit under de första två åren av störningen (ett år hos
barn och ungdom); dvs. störningen förklaras inte bättre med kronisk egentlig depression eller med egentlig depres-
sion i partiell remission.
Obs: En tidigare egentlig depressionsepisod kan ha förekommit om den gått i fullständig remission (dvs. inga signi-
fikanta symtom under två månader) innan dystymin utvecklats. Om en egentlig depressionsepisod pålagras dystymin
någon gång efter de första två åren (ett år hos barn och ungdomar) kan båda diagnoserna ställas.
E. Maniska, blandepisoder mani/depression eller hypomana episoder (se ovan) har aldrig förekommit. Kriterierna för
cyklotymi har aldrig varit uppfyllda.
F. Störningen förekommer inte uteslutande under loppet av en kronisk psykos, t ex schizofreni eller vanföreställnings-
syndrom.
G. Symtomen beror inte på direkta fysiologiska effekter av någon substans (t.ex. missbruksdrog, medicinering) eller av
somatisk sjukdom/skada (t.ex. hypotyroism).
H. Symtomen orsakar kliniskt signifikant lidande eller försämrad funktion i arbete, socialt eller i andra viktiga avseen-
den.
Depression UNS (311)
Kategorin depression UNS innefattar störningar med depressiv förstämning som inte uppfyller kriterierna för egentlig
depression, dystymi, maladaptiv stressreaktion med nedstämdhet eller maladaptiv stressreaktion med både ångestkänslor
och nedstämdhet. I vissa fall kan även depressiv symtomatologi utgöra en del av ett ångestsyndrom UNS.
24 Information från Läkemedelsverket 5:2005
Behandlingsrekommendation
Farmakologisk behandling av depression hos barn och ungdomar
Faktaruta 2. ICD-10
För diagnosen lindrig egentlig depression enligt ICD-10 krävs
A. att minst två av symtomen nedstämdhet, energifattigdom och minskad aktivitet dominerat under minst de senaste två
veckorna
B. att detta inte kan förklaras av annan kroppslig eller psykisk störning
C. att minst ett av följande symtom också förekommer, eller totalt minst fyra symtom från A och C:
1. förlust av självförtroende och självuppskattning
2. överdriven eller obefogad självkritik och nedvärdering av sig själv
3. återkommande tankar på död eller självmord, och all slags självskadande beteende
4. upplevd nedsättning av förmågan till tankeverksamhet och koncentration, med vankelmod och beslutsångest
5. förändrad psykomotorisk aktivitet med antingen minskad rörlighet eller agitation
6. all slags sömnproblem
7. ökad eller minskad matlust med medföljande effekt på vikten
Vid lindrig depression är patienten i obalans, men kan i allmänhet genomföra normala aktiviteter.
För att
måttlig egentlig depression skal föreligga krävs kriterier för lindrig depression samt minst sex symtom från A och C.
Vid måttlig egentlig depression
är patienten oftast så påverkad att även vardagliga sysslor är svåra att genomföra.
För att diagnosen
svår egentlig depression krävs att alla tre symtom från A och minst fem symtom från C föreligger.
Vid svår egentlig depression är patienten handikappad, har ofta starka sjävförebråelser och självmordstankar samt ofta
framträdande kroppsliga symtom bland de som redovisats under punkt C.
Faktaruta 3. Exempel på skattningsskalor som ofta används i kliniken
Intervjubaserade skattningsskalor
Children´s Depression Inventory (CDI)
CDI innehåller 27 items med vardera tre svarsalternativ, som med poängsättning 0–2 ger maximalt möjliga 54 poäng. >13
poäng ger stöd för depression, >15 för medelsvår och >20 för svår depression (Kovacs 1985). CDI kan även användas för
självskattning, men skattning i intervjuform är att föredra.
Montgomery Åsberg Depression Rating Scale (MADRS)
MADRS (Montgomery, et al. 1979) innehåller tio variabler med för varje item sju alternativ och med poängsättning 0–6.
Variablerna representerar de operationella A-kriterierna för egentlig depression enligt DSM-IV. Instrumentet är ursprung-
ligen utvecklat för vuxenåldrarna, men kan med fördel även användas i ungdomsåren. Maximalt möjliga är 60 poäng, >20
poäng ger stöd för medelsvår och >30 poäng ger stöd för svår depression.
K-SADS-PL
K-SADS-PL (Kaufman, et al. 1997 och 2000) är en semistrukturerad diagnostisk intervju som syftar till att undersöka
nuvarande och tidigare episoder av ett brett spektrum av psykopatologi, inklusive egentlig depression, dystymi och an-
dra affektiva sjukdomar, hos barn och ungdomar i åldrarna 6–18 år. Skattningen (0–3) baseras på information från såväl
föräldrar och barn som andra uppgiftskällor och diagnos ställs i enlighet med kriterierna i DSM-III-R och DSM-IV. En
ostrukturerad inledande intervju, en screeningintervju och en fördjupning inom fem olika diagnosområden, varav ett är
affektiva störningar, inkluderas.
Svensk validering saknas, men instrumentet finns översatt till svenska (Ivarsson, et al. 2000).
Självskattningsskalor
Beck´s Depression Inventory (BDI-C)
BDI är ursprungligen konstruerat för vuxna, men en omarbetad version (BDI-C) finns för tonåringar (13–18 år). Formu-
läret består av 21 frågor, vardera med fyra till fem alternativa skattningsalternativ. Svensk standardisering finns (Larsson &
Melin 1990, Olsson & von Knorring 1997). Maximalt kan man få 63 poäng, >15 poäng ger stöd för medelsvår depression
och >20 poäng ger stöd för svår depression.
Montgomery Åsberg Depression Rating Scale (MADRS-S)
Denna självskattningsvariant av MADRS innehåller nio av de tio items som nämnda instrument inkluderar och kan använ-
das initialt före en intervju enligt MADRS. Uppbyggnaden överensstämmer med MADRS, men intervjuarens bedömning
av individens grundstämning har exkluderats. Liksom MADRS lämpar detta instrument sig väl framför allt för åldersspan-
net 13–18 år. Maximalt kan man få 53 poäng, >18 poäng ger stöd för medelsvår depression och >27 poäng ger stöd för
svår depression.
Birleson Depression Self Rating Scale (DSRS)
Denna självskattning består av 18 items med tre svarsalternativ och poängsättning noll till två. Maximalt kan man få 36
poäng, >14 poäng ger stöd för depression. Svensk standardisering finns för ungdomar. Denna skala kan användas av både
prepubertala barn och ungdomar.
Generell funktion- och symtomskattningsskala
Children´s Global Assessment Scale (C-GAS)
C-GAS (Shaffer, et al. 1985), som finns översatt till svenska (Helgesson & Gustafsson 2001) används för skattning av den
generella funktionsnivån hos barn och ungdomar i åldrarna 4–18 år. Skattning sker på en kontinuerlig skala 1–100, där ett
är lägsta och 100 högsta funktionsnivå. För skattningen kan som hjälp användas exempelsamling (Spurkland & Vandvik
1992) översatt till svenska (Helgesson 2001).
Information från Läkemedelsverket 5:2005 25
Behandlingsrekommendation
Farmakologisk behandling av depression hos barn och ungdomar
Intervjubaserade skattningar är särskilt lämpliga som
ring utifrån effekt- och säkerhetsdata hos vuxna kan
del av den kliniska bedömningen av djupt deprime-
endast göras i begränsad omfattning utom möjligen
rade patienter medan självskattningsskalor lämpar sig
då det gäller äldre tonåringar. Den kunskap som trots
för behandlingsuppföljning av framför allt tonåringar.
detta finns rörande effekt och säkerhet av antidepres-
Inom barn- och ungdomsområdet används ofta CDI
siva läkemedel hos barn bygger huvudsakligen på ett
i åldrarna 8–13 år och MADRS och BDI i åldrarna
begränsat antal korttidsstudier på selektiva seroto-
däröver. K-SADS-PL kan användas i alla åldersgrup-
ninåterupptagshämmare (SSRI).
per medan DSRS kan användas av prepubertala barn
Bland antidepressiva farmaka har fluoxetin den
samt ungdomar. Även en skattning med en global
mest övertygande kliniska dokumentationen med ef-
funktionsskattningsskala som C-GAS är av stort vär-
fekt utöver placebo visad i tre oberoende korttidsstu-
de vid den initiala bedömningen och vid uppföljning
dier. Fluoxetin är godkänt för behandling av egentlig
av behandlingen.
depression hos barn och ungdomar i USA. Läkemed-
Behandling
let är ännu ej godkänt inom EU, främst på grund
av farhågor från djurförsök (se nedan). Även enstaka
Allmänna rekommendationer
studier med sertralin och citalopram har visat effekt.
Inledningsvis bör en inventering av barnets livs- och
För paroxetin har effekt ej kunnat visas. Fluvoxamin
relationssituation (familj, skola, kamrater) ske. Om
och escitalopram har inte studerats på barn och ung-
möjligt bör båda föräldrarna engageras så att en så
domar med depression. Djurstudier, liksom fallrap-
komplett bild som möjligt av patientens hela situa-
porter, tyder på att behandling med SSRI-preparat,
tion kan erhållas och behandlingen genomföras på
dvs. inte enbart fluoxetin, kan hämma längdtillväxten
bästa sätt. Råd om livsstilsförändringar (dygnsrytm,
liksom skelettuppbyggnad och sexuell utveckling.
motion, kost, alkohol och andra droger) ges. En
För SSRI och nyare antidepressiva har en ökad fö-
noggrann symtombeskrivning med ett etablerat in-
rekomst av självmordsbeteende och självdestruktivt
strument (se ovan) hjälper ofta patienten att förstå
beteende rapporterats. I kliniska prövningar rör det
sin situation.
sig oftast om en incidens på mindre än fem procent
I de fall depressionen är relaterad till psykosociala
och en ej signifikant riskökning jämfört med placebo
problem, t.ex. mobbning eller sociala missförhållan-
på en till två procentenheter. Inga fullbordade suicid
den, inriktas behandlingen främst mot dessa.
har rapporterats i de placebokontrollerade studierna.
Vem ska behandla?
Serotonin- och noradrenalinåterupptagshämma-
Depressionstillstånd hos barn och ungdomar bör
ren (SNRI) venlafaxin har i studier inte varit bättre
behandlas inom verksamhet som har kompetens för
än placebo. Detta gäller även mirtazapin, en presy-
psykosocial intervention liksom, i förekommande fall,
naptisk alfa 2-receptorblockerare. För venlafaxin har
kunskap om psykofarmakologisk behandling av barn
problem med självmordsbeteende och självdestruk-
och ungdomar. I verksamheten bör det också finnas
tivt beteende av minst samma storleksordning som
god kunskap om barns och ungdomars utveckling
för SSRI rapporterats.
samt betydelsen av familj och nätverk.
Gastrointestinala besvär, t.ex. diarré och illamåen-
de, och huvudvärk dominerar bland de biverkning-
Psykoterapi
ar som rapporterats vid behandling med SSRI och
Det finns ett stort antal psykoterapeutiska metoder
SNRI, särskilt vid inledning av behandlingen. Dessa
men effekterna av flertalet av dessa har studerats ve-
besvär är normalt övergående. Biverkningar som kan
tenskapligt i ringa omfattning. I praktiken är också
kvarstå under behandlingen är bl.a. svettningar och
tillgängligheten av de vetenskapligt dokumenterade
sexuella störningar.
metoderna begränsad och ojämnt fördelad i landet.
Hos barn har tricykliska antidepressiva (TCA) inte
Mest studerat är kognitiv beteendeterapi (KBT).
visats vara effektivare än placebo, men kan orsaka be-
Vid måttlig depression utan suicidrisk finns enligt
tydande biverkningar, bl.a. hjärtrytmrubbningar. För
SBU:s rapport ”Behandling av depressionssjukdo-
ungdomar finns däremot ett begränsat vetenskapligt
mar” från 2004 starkast vetenskapligt stöd för KBT
stöd för att tricykliska antidepressiva har en viss effekt
i grupp, något svagare stöd för individuell KBT och
mot depression.
för interpersonell terapi (IPT). För andra psykotera-
I de fall läkemedelsbehandling efter noggrant
piformer för barn och ungdomar redovisas svagt el-
övervägande blir aktuell rekommenderas att barnet
ler obefintligt vetenskapligt stöd. Vid behandling av
och föräldrarna informeras om vilka effekter och
vuxna finns däremot stöd för effekt av vissa andra ty-
biverkningar som noterats i de kliniska studierna.
per av korttidspsykoterapier.
Föräldrarna har en viktig roll att fylla under behand-
För barn under åtta år finns inget vetenskapligt
lingen bland annat genom att hjälpa till med medici-
stöd för psykoterapeutisk behandling.
neringen och genom att vara observanta på eventu-
Läkemedelsbehandling
ella biverkningar.
Det finns inga läkemedel godkända för behandling
De riktlinjer för farmakologisk behandling av depres-
av depression hos barn och ungdomar och extrapole-
sion hos barn som ges nedan bygger dels på den kun-
26 Information från Läkemedelsverket 5:2005
Behandlingsrekommendation
Farmakologisk behandling av depression hos barn och ungdomar
skap som genererats i de kliniska studierna, dels på den
Före och under behandling bör tillväxt och puber-
kliniska erfarenhet som expertgruppen besitter.
tetsutveckling (längd, vikt, pubertetsstadium enligt
• Vid lindrig depression är läkemedelsbehandling
Tanner, inklusive testikelstorlek respektive menstrua-
inte indicerad. Vid behandlingsbehov ges psyko-
tioner) registreras. Skattningsskalor (se ovan) är ett
social intervention.
hjälpmedel vid utvärderingen av behandlingsresulta-
• För barn under åtta år finns inte indikation för
tet.
läkemedelsbehandling då vetenskapligt stöd sak-
Vid psykofarmakabehandling skall man, liksom vid
nas.
all läkemedelsbehandling, vara uppmärksam på före-
• Vid medelsvår depression, där det föreligger psy-
komst av interaktioner, inte bara vad gäller förskrivna
komotorisk hämning, sömnproblem, aptitpåver-
läkemedel inklusive p-piller utan också naturläkeme-
kan och/eller uttalad anhedoni (minskat intresse
del, alkohol, narkotika och tobak.
eller glädje för nästan allt), hos barn från åtta års
De antidepressiva läkemedlens effektdokumen-
ålder och ungdomar, kan tillägg med farmaka vara
tation för barn- och ungdomar består av korttids-
motiverad om inte psykosociala interventioner gi-
studier. Kunskap saknas för hur länge den unga pa-
vit tecken på förbättring efter 6–8 veckor.
tienten, som svarat på behandling och blivit stabilt
• Vid svår depression med en tydlig melankolisk
symtomfri, bör fortsätta sin behandling. För vuxna
bild och påtaglig psykomotorisk hämning eller
rekommenderas fortsatt behandling under minst sex
psykotisk bild och då tillståndet inte påverkas av
månader för att förhindra återfall i depression, och
yttre omständigheter, kan det vara indicerat att
begränsade data talar för att samma rekommendation
direkt börja behandla med farmaka samtidigt med
skall ges för behandling av barn och ungdomar.
psykosociala interventioner.
Utsättning måste göras successivt under 6–12
• De bäst dokumenterade läkemedlen, såväl när
veckor för att förhindra s.k. utsättningsfenomen som
det gäller effekt som biverkningar återfinns inom
till exempel huvudvärk, illamående, yrsel, parestesier
SSRI-gruppen.
samt symtom som kan likna depressionssymtom. Ris-
Uppföljning av läkemedelsbehandling
ken för utsättningsfenomen anses vara något större
Det är lämpligt med ett återbesök inom sju till tio
hos barn och ungdomar än hos vuxna och tycks vara
dagar efter att behandlingen inletts. Allmänt gäl-
mindre för vissa substanser med lång halveringstid,
ler att läkaren bör vara väl tillgänglig för patienten
till exempel fluoxetin.
och anhöriga. Patienten bör följas regelbundet vad
Risken för återfall är stor men dokumentation rö-
gäller depressionssymtomens svårighetsgrad och bi-
rande profylaktisk långtidsbehandling saknas. Effekt
verkningar. Särskilt bör eventuell ångest, rastlöshet,
och biverkningar av depressionsbehandling (antide-
aggressivitet, sömnstörningar och förstärkta själv-
pressiva läkemedel/psykoterapi) bör om möjligt föl-
mordstankar uppmärksammas under de första veck-
jas inom ramen för ett nationellt kvalitetsregister.
ornas läkemedelsbehandling. Man bör även vara
Elektrokonvulsiv behandling (ECT)
uppmärksam på att behandling med antidepressiva
Vid mycket svårbehandlade och djupa depressions-
kan utlösa en mani hos dem som har en bipolär sjuk-
tillstånd kan ECT övervägas.
domsdisposition. Detta är vanligare när depression
debuterar i låg ålder.
Information från Läkemedelsverket 5:2005 27
Behandlingsrekommendation
Farmakologisk behandling av depression hos barn och ungdomar
Deltagarlista
Deltagarnas jävsdeklarationer kan erhållas från Läkemedelsverket.
Senior expert Jane Ahlqvist-Rastad
Senior expert Ulla Liminga
Läkemedelsverket
Läkemedelsverket
Box 26
Box 26
751 03 Uppsala
751 03 Uppsala
Doktor Kerstin Asplund
Senior expert Hans Melander
Kvinnohälsan
Läkemedelsverket
Box 601
Box 26
832 23 Frösön
751 03 Uppsala
Assistent Kristina Bergström
Farmaceut Marianne Møller
Läkemedelsverket
Institut for Rationel Farmakoterapi
Box 26
Lægemiddelstyrelsen
751 03 Uppsala
Axel Heides Gade 1
2300 København S.
Projektsamordnare Christina Brandt
Danmark
Läkemedelsverket
Box 26
Professor emeritus Martin Ritzen
751 03 Uppsala
Barnendokrinologen
Karolinska univ. sjukhuset, Solna
Senior expert Barbro Gerdén
171 76 Stockholm
Läkemedelsverket
Box 26
Skol-Psykiatriker Mona Näreskog
751 03 Uppsala
Skolhälsan
Utbildningsförvaltningen
Överläkare/Docent Per Gustafsson
104 22 Stockholm
Barn & ungdomspsykiatriska kliniken
Universitetssjukhuset
Överläkare Sten Thelander
581 85 Linköping
Projektledare SBU-rapporten
Fastlagsv 40
Med. Doktor Agnes Hultén
126 47 Hägersten
NASP
Karolinska institutet
Professor Anne-Liis von Knorring
171 76 Stockholm
Barn & ungdomspsykiatriska kliniken
Akademiska sjukhuset
Professor Bruno Hägglöf
751 85 Uppsala
Enheten för barn- och ungdomspsykiatri, By 23
Norrlands universitetssjukhus
Överläkare, Docent Björn Wrangsjö
901 85 Umeå
BUP
Box 17564
Överläkare, Med dr, Lars-Olof Janols
118 91 Stockholm
Barn & ungdomspsykiatriska kliniken
Akademiska sjukhuset
751 85 Uppsala
28 Information från Läkemedelsverket 5:2005
Farmakologisk behandling av depression
hos barn och ungdomar – en uppdatering av
kunskapsläget
– Bakgrundsdokumentation
Artiklar publicerade under rubriken Bakgrundsdokumentation är författarnas enskilda manuskript.
Budskapet i dessa delas därför inte alltid av expertgruppen i sin helhet.
Uppdatering av SBU-rapport
”Effekten av behandling med farmaka vid depression
hos barn och ungdomar”
Anne-Liis von Knorring
Efter att SBU publicerade en genomgång av kontrol-
i USA (FDA) har meddelat att de bedömt att pa-
lerade behandlingsstudier av antidepressiva farmaka
roxetin inte är visat effektivare än placebo (2). De
till barn och ungdomar med depression har det till-
brittiska och amerikanska läkemedelsmyndigheterna
kommit flera placebokontrollerade studier. Här ned-
avråder också från användning av paroxetin för be-
an sammanfattas dessa.
handling av depressioner hos barn och ungdomar på
Fluoxetin
grund av en ökad förekomst av självmordstankar och
självmordsförsök (2,3).
Ungdomar 12–18 år med egentlig depression indela-
des i fyra grupper. Den första fick fluoxetin 10–40 mg
Sertralin
(N=109), den andra fick placebo (N=112), den tredje
Sertralin, 50–200 mg per dygn (medeltal 131 mg)
fick kognitiv beteende terapi (CBT, N=111) och den
jämfördes med placebo hos 189 respektive 187 barn
fjärde fick kombinationsbehandling av fluoxetin och
och ungdomar 6–17 år gamla (4). Detta är ursprung-
CBT (N=107) (1). Studien pågick under tolv veck-
ligen två separata studier, som slagits ihop till en. Stu-
or och jämn könsfördelning förelåg. Nästan hälften
dien startade med två veckors utvärdering. Alla hade
(48 %) hade förutom depression en ytterligare och på-
medelsvår eller svår depression. Majoriteten (86 %)
gående psykiatrisk diagnos. Vanligast var ångeststör-
hade sin första episod. Hälften hade hereditet för de-
ning (27 %) och utagerande beteende (23 %). Endast
pression. Endast 40 % hade en ytterligare psykiatrisk
10 % hade dystymi-diagnos, men den genomsnittliga
diagnos. De vanligaste var ångeststörning och trots-
durationen i depressiv fas var 40 veckor (3–572). De
syndrom. Patienterna randomiserades till sertralin el-
flesta (86 %) hade sin första depressiva episod under
ler placebo och denna del av studien varade tio veck-
studien och nästan alla (98 %) skattades lida av med-
or. Andelen yngre barn 6–11 år var 47 %. De som
elsvår eller svår depression. Kombinationsbehandling
behandlats med sertralin förbättrades signifikant mer
med fluoxetin och CBT var signifikant bättre än en-
än de som fick placebo. Redan efter en veckas be-
bart fluoxetin (p=0,02), CBT (p=0,001) eller place-
handling fanns en skillnad vad gäller global förbätt-
bo (p=0,001). I jämförelse mellan enbart fluoxetin
ring (CGI-I) och efter två veckor såg man också skill-
och CBT var fluoxetin signifikant bättre (p=0,01).
nad med skalor som mätte depressionens svårighet
Det förelåg ingen statistiskt signifikant skillnad mel-
(CDRS-R och CGI-S). Bäst förbättring sågs vad gäl-
lan CBT och placebo vad gällde svaret på behandling
ler symtomen irritation, självförtroende, gråt, oenga-
(p=0,4). Andelen responders var 71 % med kombi-
gerat tal och underaktivitet. Ungdomar förbättrades
nationbehandling, 61 % med enbart fluoxetin, 43 %
mer än de yngre barnen (6–11 år). Vid studiens slut
med CBT och 35 % med placebo.
mötte 69 % av dem som fått sertralin kriterierna för
Paroxetin
respons (40 % förbättring enl. CDRD-R) och 59 %
av dem som fick placebo.
Ytterligare två studier av paroxetin som jämfört med
placebo har genomförts vilka inte visade någon skill-
nad mellan grupperna. Läkemedelsmyndigheten
Information från Läkemedelsverket 5:2005 29
Bakgrundsdokumentation
Farmakologisk behandling av depression hos barn och ungdomar
Citalopram
Citalopram
har prövats i en studie som pågick åtta
i blind design fortsatte de som började med placebo
veckor på barn 7–17 år med egentlig depression (5).
att behandlas med placebo. Efter 19 veckor rando-
De randomiserades efter en veckas enkel-blindbe-
miserades de som gått i remission (CDRS-R <28)
handling till citalopram 20–40 mg (N=89, 45 barn
på fluoxetin till placebo eller fortsatt fluoxetin (9).
och 44 ungdomar) eller till placebo (N=85, 38 barn
Sammanlagt ingick 75 barn och ungdomar 8–17 år i
och 47 ungdomar). Den genomsnittliga varaktighe-
denna del av studien (40 med fluoxetin och 35 med
ten i depressionsepisoden var knappt 20 månader och
placebo). Medeltalet för tiden till återfall var 180±17
för majoriteten (80 %) var det första episoden. Diag-
dagar för dem som fick fortsatt fluoxetin och 71±10
noserna ADHD, PTSD, PDD, CD, ODD, mental
för dem som fick placebo (p<0,05). Återfall definie-
retardation och alkohol/drogmissbruk uteslöt delta-
rades som CDRS-R <40 och förvärring av depres-
gande i studien. Psykoterapi eller beteendeterapi fick
sionssymtom under två veckor eller att det kliniskt
inte ha påbörjats tre månader före screeningen eller
bedömdes vara en försämring. Relaps förelåg hos
under studien. Vid studiens slut hade 36 % med cita-
21 % i fluoxetingruppen och 47 % i placebogruppen.
lopram och 24 % med placebo svarat (p<0,05). Svar
Vid studiens slut var förändringen från baseline inte
definierades som <28 enligt CDRS-R. Effektstorle-
signifikant skilda mellan fluoxetin och placebo vad
ken var 2,9.
gäller CDRS-R totalt, men CGI-I var bättre hos dem
En ytterligare studie har gjorts på ungdomar 13–18
som fått fluoxetin än de som fått placebo (1,9+1,2 vs
år, där 124 randomiserades till citalopram och 120 till
3,2+1,8, p=0,011).
placebo (6). De som tagit första tabletten utgjordes
Självskadande beteende
av 121 med citalopram och 112 med placebo. Sjut-
På senare tid har en annan biverkan rapporterats för
tiofyra procent utgjordes av flickor. Majoriteten hade
SSRI och nyare antidepressiva, vilket är en ökad fö-
svår depression (MADRS 30±5, GAF 55±7). Effek-
rekomst av självmordstankar och självdestruktivt be-
ten mättes med K-SADS-P, BDI och MADRS. Stu-
teende under första veckorna av behandlingen hos
dien pågick under tolv veckor. Omkring 1/3 avbröt i
ungdomar. Detta är särskilt uttalat för paroxetin och
båda grupperna. Man fann ingen signifikant skillnad
venlafaxin. Det rör sig dock endast om mindre än
mellan aktiv substans eller placebo. Andelen som sva-
fem procent av de behandlade patienterna (10). Inga
rade på behandling (nedstämdhet och anhedoni <2
fullbordade suicid har rapporterats från de placebo-
enligt K-SADS-P) var 59 % i citalopramgruppen och
kontrollerade studierna. I en studie rörande antide-
61 % i placebogruppen. Eftersom 2/3 även fick olika
pressiv behandling i primärvård fann man att risken
former av psykoterapi gjordes en post-hoc-analys av
för självskadande beteende upp till 18 år var något
dem som inte fått någon sådan behandling och 52 %
ökad (OR 1,6) hos dem som fått behandling med
citaloprambehandlade jämfört med 22 % placebobe-
SSRI jämfört med dem som fått tricyklika (11). Inga
handlade svarade på behandling, dvs. MADRS-poäng
fullbordade suicid fanns rapporterade.
minskade med >50 % (p<0,05).
Slutsatser
Fluvoxamin
• Det finns stöd för att fluoxetin är effektivare än
Studier med fluvoxamin vid depression har inte pu-
placebo för korttidsbehandling av depression
blicerats eller redovisats på kongresser.
(Evidensgrad A).
• Det finns visst stöd för att sertralin och citalopram
Venlafaxin
har effekt mot depression hos ungdomar (Evi-
Två studier, som inte publicerats, har tillkommit där
densgrad B).
venlafaxin jämförts med placebo hos 7–17 år gamla
• Paroxetin har inte visats ha bättre effekt än pla-
barn med egentlig depression. Enligt sammanfatt-
cebo i en publicerad och två opublicerade studier
ning från FDA har ingen skillnad i effekt mellan de
(Evidensgrad A).
som fick aktiv substans och placebo påvisats i dessa
• För fluvoxamin saknas helt publicerade studier.
studier (7).
• Studier av långtidseffekt visar visst stöd för att flu-
Långtidsbehandling med antidepressiva
oxetin kan minska återfall (Evidensgrad B).
• Inga antidepressiva är godkända i Sverige för be-
En placebokontrollerad studie rörande återfallspre-
handling av barn och ungdomar.
vention med fluoxetin finns publicerad (7). Barn
• I jämförelse mellan kognitiv beteendeterapi
och ungdomar randomiserades efter att ha svarat på
(CBT) och fluoxetin finns det visst stöd för att
behandling med fluoxetin 20–60 mg i en placebo-
farmakabehandling har bättre effekt på depression
kontrollerad behandlingsstudie (8). Studien rörande
än CBT (Evidensgrad B).
återfallsprevention varade 32 veckor av sammanlagt
• Det finns visst stöd för att kombinationsbehand-
51 veckor. Efter akutstudien blev de som inte sva-
ling CBT och fluoxetin är bättre än enbart fluox-
rade på fluoxetin 20–40 mg upptitrerade till 60 mg
etin (Evidensgrad B).
fluoxetin. De som svarade på behandling med 20 mg
fick stå kvar på denna dos. För att bibehålla studien
30 Information från Läkemedelsverket 5:2005
Bakgrundsdokumentation
Farmakologisk behandling av depression hos barn och ungdomar
ärkning
ärkning
. placebo
Anm
Anm
fluox+CBT N=107
1 v run-in
hög placebo respons
rkningä
e suicidalitet
Anm
mindr med CBT
fekt
Ef
fluox >plac
fekt
tr >plac
Ef
ser
flux >plac
cit >plac
cit=plac
ej psykoter cit >plac
fekt
Ef
fl+CBT > fl fl+CBT> CBT fluox > CBT
ått
M
CDRS-R CGI-I
ått
M
CDRS-R CGI-I
CDRS-R CGI RADS SIQ-Jr
CDRS-R CGI
K-SADS- BDI MADRS
tt
konc.
å
M
CDRS-R CGI RADS SIQ-Jr
Plasma
nej
Plasma konc.
nej
nej
nej
ja
ession
Plasma konc.
nej
ession
Dos mg
20–60
Dos mg
10–40
Dos mg
50–200
10–40
20–40
10–40
id
erapi (CBT) vid depr
id
T veckor
32
T veckor
12
ession.
id
T veckor
10
12
8
12
Substans
fluox
Substans
fluox
tralin
Substans
ser placebo
fluoxetin placebo
citalopram placebo
citalopram placebo
evention med fluoxetin och placebo vid depr
Diagnos
MDD DSM-IV
fallspr
Diagnos
MDD DSM-IV
-
Diagnos
MDD DSM-IV
MDD DSM-IV
MDD DSM-IV
MDD DSM-IV
-
Antal (ak tiv/plac)
75 (40/35)
upp –
ollerade studier av SSRI och placebo vid depr
ollerad studie av fluoxetin och Kognitiv Beteende T
ollerad studie av åter
Antal totalt aktiv/placebo
376 (189/187)
327 (216/112)
178 (93/85)
244 (124(120)
subgr ej psykoter 65 (29/36)
Antal (cbt+aktiv/ak tiv/cbt)
(107/109/111)
lder
Å år
8–17
lder
lder
Å rå
12–17
Å år
6–17
12–17
12–17
13–18
ring
ch
ch 2004
agner
agner
Knor
Studie
W 2003
Mar 2004
W 2004
v 2005
Studie
Emslie 2004
Tabell I. Randomiserade kontr
abell II. Randomiserad kontrT
Studie
Mar
Tabell III. Randomiserad kontr
Information från Läkemedelsverket 5:2005 31
Bakgrundsdokumentation
Farmakologisk behandling av depression hos barn och ungdomar
Referenser
1. March JS, TADS team. Flouxetine, Cognitive-Behavioral The-
7. Dubitsky GM. Review and evaluation of clinical data. Pla-
rapy, and their Combination for Adolescents with Depression.
cebo-controlled antidepressant studies in pediatric patents.
Treatment for Adolescents With Depression Study (TADS)
FDA, HFD 120,2004.
Randomized Controlled Trial JAMA 2004;292(7):807–20.
8. Emslie GJ, Heiligenstein JH, Wagner KD, et al. Fluoxetine
2. FDA statement regarding the anti-depressant Paxil for pedia-
for acute treatment of depression in children and adolescents:
tric population. In: Food and Drug Administration (FDA),
a placebo-controlled, randomized clinical trial. J Am Acad
USA;2003.
Child Adolesc Psychiatry 2002;41(10):1205–15.
3. Duff G. Safety of Seroxat (paroxetine) in children and adol-
9. Emslie GJ, Heiligenstein JH, Hoog SL, et al. Fluoxetine Tre-
escents under 18 years - contraindications in the treatment
atment for Prevention of Relapse of Depression in Children
of depressive illness. In: Medicines and Healthcare products
and Adolescents: A Double-Blind, Placebo-Controlled Study.
Regulatory Agency (MHRA), UK;2003.
J Am Acad Child Adolesc Psychiatry 2004:43:1397–405.
4. Wagner KD, Ambrosini P, Rynn M, et al. Efficacy of sertra-
10. Mosholder AD. Suicidality in pediatric clinical trials of anti-
line in the treatment of children and adolescents with major
depressant drugs: Comparison between previous analyses and
depressive disorder. Two randomized controlled trials. JAMA
Colombia University classification. FDA, D040495,2004.
2003;290(8):1033–93.
11. Martinez C, Rietbrock S, Wise L, et al. Antidepressant treat-
5. Wagner KD, Robb AS, Findling RL, et al. A Randomized,
ment and the risk of fatal and non-fatal self harm in first episode
Placebo-Controlled Trial of Citalopram for the Treatment of
depression: nested case-control study. BMJ 2005;330:389.
Major Depression in Children and Adolescents. Am J Psychia-
try 2004;161:1079–83.
6. von Knorring A-L, Olsson GI, Thomsen PH, et al. A rando-
mised double-blind placebo-controlled study of citalopram in
adolescents with major depressive disorder. J Clin Psychop-
harm 2005. Re-submitted.
32 Information från Läkemedelsverket 5:2005
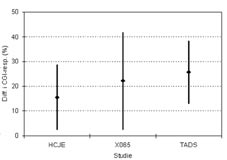
Bakgrundsdokumentation
Farmakologisk behandling av depression hos barn och ungdomar
Fluoxetin vid egentlig depression hos barn och
ungdomar
Hans Melander
Klinisk effekt
Den kontrollerade kliniska effektdokumentationen
dock vid intolerans kunde halveras genom varannan-
består av tre korttidsstudier, varav en var företagsdri-
dagsmedicinering.
ven (HCJE) och två prövarinitierade (X065, TADS),
Effektmått
samt en fortsättningsstudie med syfte att studera rel-
Gemensamma skattningsskalor i de tre studierna var
apsförebyggande effekt.
Children’s Depression Rating Scale-Revised (CDRS-
Korttidsstudier
R) och Clinical Global Impression of Improvement
(CGI-Improvement). I studierna HCJE och X065
Design
användes CDRS-R-responders (minst 30 % reduk-
I samtliga studier jämfördes fluoxetin med placebo i
tion av den initiala poängen) som primärt effekt-
en parallellgruppsstudie med åtta (HCJE och X065)
mått medan två primära effektmått specificerades i
eller tolv (TADS) veckors dubbelblind behandling. I
TADS, totalpoäng på CDRS-R och CGI-responders
två studier (HCJE och X065) föregicks den dubbel-
(Very much improved or Much improved). Bland
blinda behandlingen av en till två veckors singelblind
de sekundära variablerna märks Children’s Depres-
placebobehandling efter vilken placeboresponders
sion Inventory, Becks Depression Inventory, Mont-
exkluderades. X065 var en singelcenterstudie med-
gomery Asberg Depression Rating Scale, Hamilton
an de övriga genomfördes som multicenterstudier .
Anxiety Rating Scale och Global Assessment of Func-
I TADS randomiserades till ytterligare två grupper i
tioning.
vilka patienterna behandlades öppet med fluoxetin
Resultat
och kognitiv beteendeterapi respektive enbart kogni-
Utfallet i korttidsstudierna uppvisade det gängse
tiv beteendeterapi.
mönstret i studier för vuxna för en substans med
Studiepopulation
antidepressiv effekt, en blandning av signifikanta och
Öppenvårdspatienter av båda könen som uppfyllde
icke-signifikanta resultat med en tydlig positiv ten-
DSM-III-R/DSM-IV-kriterierna för egentlig de-
dens överlag (Tabell I och Figur 1).
pression och ansågs normalbegåvade samt i studierna
HCJE och TADS hade en initial CDRS-R-poäng
över 40 respektive 44, kunde inkluderas. I HCJE och
X065 inkluderades både barn och ungdomar (8–17
år) medan endast ungdomar (12–17 år) studerades i
TADS. Patienter med andra psykiska störningar (bi-
polär störning, psykotisk depression, ätstörningar,
oberoende sömnstörning, borderline-personlighet)
och annan allvarlig samtidig sjukdom exkluderades.
Även patienter för vilka hög suicidal risk ansågs före-
ligga exkluderades.
Dosering
I studie HCJE och TADS tillämpades flexibel do-
sering med en startdos på 10 mg/dag som efter en
vecka höjdes till 20 mg och i den senare studien om
Figur 1. 95 % konfidensintervall för skillnad i andelen
möjligt och nödvändigt kunde höjas ytterligare till
CGI-responders (%) i placebo-kontrollerade korttids-
40 mg. I X065 studerades fast dosering 20 mg, som
studier
Tabell I. Förändring i CDRS-R och CDRS-R-responders i placebokontrollerade korttidsstudier
Studie/
Variabel
Fluoxetin
Placebo
P-värde
Antal patienter
HCJE
Total CDRS-R
-22,1
-14,9
<0,001
N =109, N =101
CDRS-R-resp.
65,1 %
53,5 %
0,093
Flu
Pla
X065
Total CDRS-R
-20,2
-10,5
0,013
N =48, N =47
CDRS-R-resp.
58,3 %
31,9 %
Flu
Pla
TADS
Total CDRS-R
-22,6
-19,4
0,100
N =109, N =112
Flu
Pla
Information från Läkemedelsverket 5:2005 33
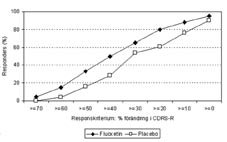
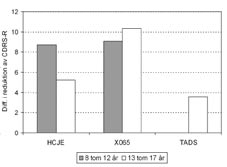
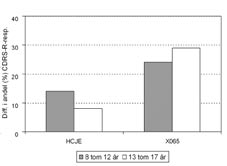
Bakgrundsdokumentation
Farmakologisk behandling av depression hos barn och ungdomar
Studie HCJE misslyckades med att uppnå signifikans
för den primära effektvariabeln, minst 30 % reduk-
tion av initial CDRS-R-poäng. Dock uppnåddes sta-
tistisk signifikans för alla övriga tänkbara responder-
definitioner (Figur 2). I TADS sågs en mindre effekt
för den ena primära variabeln Total CDRS-R-poäng
medan resultatet för den andra primära variabeln
CGI-responders var väl i nivå med utfallet i övriga
studier (Figur 1).
Figur 3. Skillnad (fluoxetin minus placebo) i reduktion
av Total CDRS-R-poäng för barn och ungdomar.
Figur 2. Andel (%) CDRS-R-responders för olika
responskriterier. Statistiskt signifikanta skillnader
(p<0,05) för >60, >50, >40, >20 och >10 % reduktion
i CDRS-R.
I separata analyser för barn och ungdomar, uppde-
lade efter ålder utan hänsyn till pubertal status, sågs
inga statistiska belägg för att effekten skulle skilja sig
mellan åldersgrupperna (Figur 3 och 4). Beträffande
reduktion av den initiala CDRS-R-poängen sågs en
Figur 4. Skillnad (fluoxetin minus placebo) i andel
tendens till mindre uttalad effekt för ungdomar. Med
(%) CDRS-R-responders för barn och ungdomar.
beaktande av den relativt goda effekten som obser-
verades i TADS för CGI-responders finns dock sam-
mantaget inget stöd för att tala om en sämre effekt
Totalt randomiserades 40 patienter till den relapsfö-
hos ungdomar jämfört med barn. Könsfördelningen
rebyggande perioden. Sex av 20 avbröt på grund av
var jämn i alla studier (46–54 % flickor) och effekt-
relaps i fluoxetingruppen jämfört med tolv av 20 i
storleken var jämförbar för de två könen.
placebogruppen (p=0,046). I en alternativ analys i
Endast enstaka blygsamma effekter av kognitiv be-
vilka endast de med en CDRS-R-poäng över 40 an-
teendeterapi sågs i TADS-studien. På grund av meto-
sågs ha uppnått en relaps sågs likartade resultat avse-
dologiska brister kan dessa effekter ej tillmätas något
ende både effektstorlek och statistisk signifikans. En
värde.
tredjedel av återfallen i placebogruppen inträffade
Underhållsbehandling
inom en månad varför en del av den observerade ef-
fektfördelen för fluoxetin kan tänkas bero på utsätt-
Kontrollerade data vid underhållbehandling är be-
ningseffekter.
gränsade och kommer från en fortsättnings-studie
till HCJE. Efter den placebokontrollerade akuta be-
Säkerhet
handlingsperioden följde en subkronisk period på tio
Säkerhetsdata från kontrollerade studier på barn och
veckor under vilken de som svarat på 20 mg fortsatte
ungdomar med egentlig depression finns för drygt
denna behandling, medan de som ej svarat randomi-
250 patienter behandlade i upp till 51 veckor. De
serades till 20 mg eller 40 mg. För den sista gruppen
flesta har behandlats med 20 mg/dag.
fanns möjlighet att höja dosen till 60 mg vid utebli-
I den sammanställning som gjorts av Lilly av stu-
vet svar efter fyra veckor. Efter den subkroniska fasen
die HCJE och X065 sågs i stora drag samma biverk-
randomiserades responders till fortsatt behandling på
ningsmönster som hos vuxna med undantag av ma-
aktuell dos eller placebo i maximalt 32 veckor.
niska reaktioner, vilka förekom mer frekvent (2,6 %)
Primär effektvariabel var tid till relaps. Relaps an-
hos barn och ungdomar, och en sänkning av alkaliska
sågs föreligga vid en CDRS-R-poäng över 40 och en
fosfater. Hyperkinesi, agitation, maniska reaktioner,
period av minst två veckors försämring eller vid en
tremor och huvudvärk rapporterades signifikant mer
försämring som enligt prövarens bedömning utgjor-
frekvent för fluoxetin jämfört med placebo. Vidare
de skäl för att avbryta behandlingen.
34 Information från Läkemedelsverket 5:2005
Bakgrundsdokumentation
Farmakologisk behandling av depression hos barn och ungdomar
sågs för fluoxetin en signifikant lägre längdtillväxt
rade händelser var nio respektive fyra.
(1,1 cm mindre än placebo) efter 19 veckors behand-
De data över självmordsrelaterade händelser som
ling.
rapporterats för fluoxetin i placebo-kontrollerade
I TADS-studien rapporterades psykiatriska biverk-
studier kan inte på något avgörande sätt anses skilja
ningar för signifikant fler patienter i fluoxetingruppen
sig från vad som rapporterats för andra SSRI, inklu-
jämfört med placebogruppen (20 vs 9). För övriga
sive paroxetin.
biverkningar sågs inga signifikanta skillnader.
Av särskilt intresse är självmordsrelaterade hän-
Slutsats
delser. Data avseende detta är dock osystematiskt
En modest genomsnittlig effekt av fluoxetin vid
redovisade i dokumentationen. Enligt Lillys sam-
egentlig depression hos barn och ungdomar har do-
manställning rapporterades bland allvarliga oönskade
kumenterats i tre korttidsstudier. Det kan ifrågasättas
händelser fyra självmordsrelaterade händelser (en
om den mest uttalade effekten sågs i X065 är repre-
självmordstankar, två självmordsförsök, en avsiktlig
sentativ för vad man kan förvänta sig i klinisk praxis.
överdos) på fluoxetin och en (avsiktlig självskada) på
Dels är studien en mindre singelcenterstudie, dels är
placebo i alla barnprövningar (exkl. TADS) (1,75 %
det den enda prövarinitierade fluoxetinstudie på barn
vs 0,53 %). Textsträngsökningar för att identifiera yt-
och ungdomar med egentlig depression som publice-
terligare fall resulterade i en total incidens för själv-
rats före år 2004 (rimligen borde fler försök ha gjorts
mordsrelaterade händelser på 3,6 % respektive 3,8 %.
sedan godkännandet i slutet på 1980-talet). HCJE
Incidenssiffrorna för självmordsförsök uppgavs till
och TADS utgör troligen en bättre grund för att ex-
2,4 % respektive 1,9 %. Vid begränsning till enbart
trapolera till klinisk praxis.
barnstudier avseende egentlig depression identifiera-
Det finns inga belägg för att effektstorleken skulle
des fyra (1,61 %) självmordsförsök för fluoxetin och
skilja sig mellan barn och ungdomar.
två (0,95 %) för placebo.
Huvudsakligen har 20 mg/dag studerats och nå-
I säkerhetsvärderingen av TADS-studien fokusera-
got starkt stöd för att de som ej svarar på 20 mg skul-
des särskilt på skaderelaterade händelser (självskada,
le ha nytta av 40 mg finns ej.
förvärrade självmordstankar, självmordsförsök, skada
Dokumentationen för långtidseffekt är knapp. Ett
av andra inklusive aggressiva eller våldsamma tankar
visst stöd finns för att fortsatt behandling efter 19
mot andra eller egendom) med självmordsrelaterade
veckor har en relapsförebyggande effekt.
händelser (självmordsförsök eller förvärrade själv-
Mycket talar för att fluoxetinbehandling av barn
mordstankar) som en undergrupp. Skaderelaterade
och ungdomar kan medföra ökad risk för skaderela-
händelser rapporterades för 13 fluoxetinpatienter och
terade händelser och självmordsrelaterade händelser.
sex placebopatienter medan antalet självmordsrelate-
Vid varje beslut att behandla måste således de förvän-
tade vinsterna vägas mot dessa potentiella risker.
Självmordsrelaterat beteende vid antidepressiv
farmakologisk behandling av barn och ungdomar
Hans Melander
Efter rapporter om att den selektiva serotoninåter-
tvångssyndrom och social fobi. Behandlingsduratio-
upptagshämmaren (SSRI) paroxetin tenderar att ge
nen varierade mellan sex och tolv veckor vid egentlig
ett ökat antal självmordsrelaterade händelser (själv-
depression och mellan åtta och sexton veckor för öv-
mordsförsök, självmordstankar och självskadebete-
riga indikationer.
ende) jämfört med placebo i studier av deprimerade
Inga självmord inträffade i de placebokontrollera-
barn och ungdomar har flera utredningar gjorts där
de studierna. För övriga självmordsrelaterade händel-
samtliga SSRI och besläktade substanser (mirtaza-
ser försvåras jämförelserna mellan de olika substan-
pin och venlafaxin) värderats ur denna aspekt. Ut-
serna av att självmordsförsök, självmordstankar och
redningarna som har gjorts av de amerikanska och
självskadebeteende rapporterades på olika sätt i olika
engelska läkemedelsmyndigheterna samt för EU:
studier och för olika substanser. Detta har hanterats
s räkning av den holländska myndigheten omfattar
på skilda sätt i de tre utredningarna varför resultaten
dels placebokontrollerade studier, dels epidemiolo-
skiljer sig något. Det övergripande mönstret, här re-
giska studier baserade på den engelska primärvårds-
presenterat av resultatet av den engelska utredningen
databasen för forskning (General Practice Research
för den sammansatta händelsen självmordsrelaterat
Database, GPRD).
beteende (Tabell I), är dock detsamma.
Placebokontrollerade studier
Även om skillnaderna är små och ej statistiskt sig-
nifikanta för de enskilda substanserna, med undantag
Av totalt 22 placebokontrollerade studier inkludera-
av venlafaxin, ses en genomgående överrisk för själv-
des patienter med egentlig depression i femton stu-
mordsrelaterade händelser på minst 1–2 %-enheter.
dier. Övriga studerade barnindikationer var ångest,
Denna överrisk är statistiskt säkerställd i en samman-
Information från Läkemedelsverket 5:2005 35
Bakgrundsdokumentation
Farmakologisk behandling av depression hos barn och ungdomar
slagen analys. För fluvoaxamin saknas placebokon-
grund av selektiv förskrivning. Patienter med tidigare
trollerade data för barn och ungdomar på depres-
självmordsbeteende eller tidigare kontakt med psykia-
sionsindikationen och för mirtazapin finns endast en
trin förskrevs oftare SSRI-preparat än tricykliska anti-
studie med en självmordsrelaterad händelse vardera i
depressiva. Det fanns även belägg för att paroxetin
test- och placebogrupp.
valdes oftare än andra SSRI för dessa riskpatienter.
I de placebokontrollerade studierna på övriga in-
dikationer var antalet självmordsrelaterade händelser
Slutsats
litet och någon överrisk kunde ej ses.
Inga självmord bland barn och ungdomar förekom
i de placebokontrollerade studierna. Inte heller rap-
Epidemiologiska studier
porterades några självmord i de epidemiologiska
I tre olika fall-kontrollstudier baserade på den eng-
studierna. Från såväl placebostudierna som de epide-
elska primärvårdsdatabasen (GPRD) med fokus på
miologiska studierna finns dock klara indikationer på
olika substanser och olika kontrollbehandlingar samt
att behandling av depression hos barn och ungdomar
olika men överlappande tidsperioder mellan 1988
med SSRI och besläktade substanser är associerade
och 2003 befanns SSRI-preparaten vara associerade
med en viss förhöjd risk för självmordsrelaterat be-
med en överrisk för självmordrelaterat beteende (Ta-
teende. Denna överrisk får potentiellt anses gälla alla
bell II). Inga självmord rapporterades i studierna.
SSRI och besläktade substanser så länge data saknas
Resultaten måste tolkas med viss försiktighet på
som visar att så ej är fallet.
Tabell I. Antal självmordsrelaterade händelser (självmordsförsök, självmordstankar och självskadebeteende) i
placebokontrollerade studier vid depression hos barn och ungdomar.
Substans
Aktiv behandling
Placebo
Antal
Antal händelser
Antal
Antal händelser (%)
patienter
(%)
patienter
Citalopram
210
19 (9,0)
197
15 (7,6)
Fluoxetin
465
31 (6,7)
321
14 (4,4)
Paroxetin
378
14 (3,7)
285
7 (2,5)
Sertralin
189
5 (2,7)
184
2 (1,1)
Venlafaxin
182
13 (7,1)
179
3 (1,7)
Tabell II. Resultat från tre fall-kontrollstudier för patienter under 19 år. Odds Ratio för självmordsrelaterade
händelser.
SSRI-preparat
Kontroll
Odds Ratio
95 % konfidensintervall
Fluoxetin
Dothiepin
1,3
0,6–3,0
Paroxetin
Dothiepin
1,7
0,7–4,1
Fluoxetin
Amitriptylin
1,4
1,0–1,9
Paroxetin
Amitriptylin
1,6
1,1–2,2
SSRI
TCA*
1,6
1,0–2,5
SSRI
Icke-SSRI**
1,8
1,0–3,2
SSRI
Icke-SSRI***
2,0
1,1–3,6
Paroxetin
Andra SSRI
1,4
0,9–2,2
*) Tricykliska antidepressiva, **) Inklusive venlafaxin, ***) Exklusive venlafaxin
36 Information från Läkemedelsverket 5:2005
Biverkningsnytt
Spelberoende - en rapporterad biverkan vid
Parkinsonbehandling
Leann Dodd och medarbetare har publicerat en ar-
spelberoende Parkinsonpatienterna. I en svensk rap-
tikel som beskriver plötsligt insättande spelmissbruk
port om spelberoende och dess samband med drog-
hos en rad Parkinsonpatienter som behandlats med
missbruk (9) framhålls att på svarta spelklubbar säljs
någon av de båda dopaminagonisterna pramipexol
amfetamin och kokain till gästerna för att stimulera
eller ropinirol (1). I Sverige förekommer dessa sub-
spelberoendet, men även alkohol och heroinmiss-
stanser i läkemedlen Sifrol respektive Requip. Arti-
bruk förekommer (dvs. ämnen vilkas beteendeeffek-
kelförfattarna presenterar elva levodopabehandlade
ter helt eller delvis medieras via dopaminfrisättning
Parkinsonpatienter, som i samband med att en dopa-
inom vissa hjärnområden). Det förefaller således som
minagonist satts in, börjat spela på kasino dagligen
om det kända stereotypa beteendet vid överdosering
eller minst två till tre gånger i veckan. De flesta hade
av centralstimulantia förekommer i form av spelbero-
någon gång tidigare prövat på att spela och i regel för-
ende vid behandling med höga doser av de nya dopa-
lorat småsummor. Men sedan de kommit upp i höga
minagonisterna av Parkinsons sjukdom.
dagsdoser av pramipexol (4,5–13,5 mg/dag; rekom-
Referenser
menderad maximiumdos 3,3 mg/dag) eller ropini-
1. Dodd ML, Klos KJ, Bower JH, et al. Pathological gambling
rol (15-21 mg/dag; rekommenderad maximumdos
caused by drugs used to treat Parkinson Disease. Arch Neurol
24 mg/dag) inleddes en period av tvångsartat spel-
2005;62.
2. Seedat S, Kesler S, Niehaus DJ, et al. Pathological gam-
missbruk, ibland med stora förluster av pengar (i ett
bling behaviour: emergence secondary to treatment of
fall $200,000). I samband med att pramipexol res-
Parkinson’s disease with dopaminergic agents. Depress Anx-
pektive ropinirol sattes ut försvann det nya spelmiss-
iety 2000;11:185–6.
bruksbeteendet. Tidigare har liknande fallrapporter
3. Gschwandtner U, Aston J, Renaud S, et al. Pathologic gam-
bling in patients with Parkinson’s disease. Clin Neuropharma-
publicerats av sammanlagt sex forskargrupper som
col 2001;24:170–2.
tillsammans presenterat femton Parkinsonpatienter
4. Driver-Dunckley E, Samanta J, Stacy M. Pathological gam-
med spelberoende under behandling med dopamina-
bling associated with dopamine agonist therapy in Parkinson’s
gonister (2–7).
disease. Neurology 2003;61:422–3.
5. Montastruc JL, Schmitt L, Bagheri H. Comportement patho-
Det är väl känt att missbrukare av centralstimulan-
logique de jeu au cours d’une maladie de Parkinson traitée par
tia under ruset kan komma in i ett stereotypt uppre-
lévodopa et bromocriptine. Rev Neurol Paris 2003;159:441–
pat beteende med inslag av tvångskaraktär. Centralsti-
3.
mulantiamissbrukarna kallar fenomenet att ”punda”
6. Kurlan R: Disabling repetitive behaviors in Parkinson’s dis-
ease. Mov Disord 2004;19:433–7.
(efter pundhuvud och termen ”punding” har till och
7. Avanzi M, Uber E, Bonta F. Pathological gambling in two
med tagits upp i engelskspråkig facklitteratur). I ett
patients on dopamine replacement therapy for Parkinson’s
sådant tillstånd kan missbrukaren i timtal upprepa en
disease. Neurol Sci 2004;25:98–101.
viss sysselsättning (t.ex. att plocka isär och sätta ihop
8. Gunne LM: Narkomani – medicinska fakta. Akademiförlaget
Göteborg 1975.
en väckarklocka eller putsa skor eller naglar) (8). För-
9. Helling S: Det är som ett kärleksförhållande. Spelmissbruk
sök att avbryta beteendet medför ångest och aggres-
bland ungdomar. CAN Rapport nr 72, 2003.
sivitetsutbrott, vilket även beskrivits hos vissa av de
Information från Läkemedelsverket 5:2005 37
Biverkningsnytt
Biverkningsarbetet år 2004
Biverkningsarbetet år 2004
Många olika uppgifter
slutsatser om exakt antal/förekomst. Spontanrappor-
teringen kompletterar därmed den information om
Året 2004 har varit ett intensivt arbetsår för Biverk-
de vanligaste biverkningarna av läkemedel som erhålls
ningsenheten på Läkemedelsverket. Rutinarbetet med
från kliniska vetenskapliga studier inför ett eventuellt
signalspaning av misstänkta läkemedelsbiverkningar
godkännande.
spontant inrapporterade i det nationella systemet
och i periodiska säkerhetsuppdateringar har utgjort
”En EU utredning om dagen”
en viktig del. Stora insatser av Läkemedelsverkets en-
Signalspaning görs även i företagens insända doku-
heter har också gjorts inom EU-samarbetet. Utöver
mentation. Läkemedelsverket har åtagit sig en bety-
detta har året också inneburit arbete med förbätt-
dande uppgift inom det gemensamma EU-arbetet.
ringsprocesser både vad gäller interna arbetsflöden
Regelverket anvisar tillverkare som ansvarar för ett
och med utvecklingsprojekt inom ramen för Biverk-
godkänt läkemedel att regelbundet inkomma med
ningsutredningen. Det har inneburit bearbetning av
säkerhetssammanställningar till myndigheterna. Det-
förslag som avser en breddning av rapportörskåren,
ta innebär att företagen med intervall lämnar in bl.a.
elektronisk rapportering, myndighetssamverkan och
statistik och fallrapporter på samtliga biverkningar av
en reformering/utveckling av signalarbetet i samråd
läkemedlet som företaget fått kännedom om under
med regionala biverkningscentra.
den period som förflutit sedan godkännandet. Läke-
Nedan redovisas signalarbetet och årsstatistiken
medelsverket har under år 2004 ansvarat för bedöm-
från den nationella spontanrapporteringen.
ning och författande av säkerhetsrapporter för 20–
Signalspaning
25% av samtliga läkemedel som godkänts inom EU,
via den centrala eller ömsesidiga proceduren, vilka
”Ökad rapportering”
sedan skickas på remiss till övriga medlemsländer. I
Spontanrapporteringen av biverkningar är fortsatt ett
praktiken har detta, baserat på antal arbetsdagar per
viktigt verktyg för säkerhetsuppföljning av läkemedel.
år, inneburit leverans av en rapport om dagen fortlö-
Den ökade rapporteringen från svenska hälso- och
pande under året 2004. Ofta leder slutsatser i sådana
sjukvården som noterades under föregående år har
rapporter till att företagen uppmanas intensivbevaka
fortsatt att öka även under år 2004. Vid årets slut
vissa typer av biverkningar eller inkomma med kom-
uppgick antalet rapporter till över 4 000 (se statistik
pletterande information alternativt åläggs att planera
nedan för mer detaljerad redovisning). En förklaring
uppföljningsstudier eller ändra produkttexterna av-
skulle kunna vara resultatet av rapporteringsfrämjan-
seende information om ex kontraindikationer, var-
de insatser som gjorts under det gångna året.
ningar och försiktighet eller information om nya bi-
Intressant att notera är en ökad rapportering från
verkningar.
sjuksköterskor samt att antalet spontana rapporter
från kvalitetsregister i sjukvården ökat. Nedan ses
Data från nationella
antal biverkningsrapporter per år under den senaste
biverkningsregistret år 2004
tioårsperioden.
För att möjliggöra en jämförelse med tidigare sam-
manställning av biverkningsdata för år 2003 har sam-
ma upplägg gjorts i nedanstående sammanställning
med biverkningsdata för år 2004 från det svenska bi-
verkningsregistret.
Antal rapporter och ålders- och
könsfördelning
Från den svenska hälso- och sjukvården inkom år
2004 till Läkemedelverket 4 185 biverkningsrappor-
ter, varav 4 087 spontanrapporter och 98 rapporter
från kvalitetsregister, s.k. icke-interventionsstudier. I
icke-interventionsstudier förskrivs läkemedlet på sed-
vanligt sätt och beslutet att ta med patienten i studien
Vilken information kan spontanrapporteringen ge?
är klart åtskilt från förskrivningen.
Det är viktigt att vara medveten om att en betydande
I nedanstående sammanställning kommer endast
underrapportering sannolikt fortfarande råder och att
data från inkomna 4 087 spontanrapporter år 2004 att
rapporteringsfrekvenser påverkas av sådana faktorer
presenteras. Rapporterna från icke-interventionsstu-
som försäljningsvolymer, tidpunkter och mediafokus.
dier redovisas separat i slutet av sammanställningen.
Systemet är därför bättre lämpat att användas för att
fånga upp signaler på ovanliga biverkningar än att dra
38 Information från Läkemedelsverket 5:2005
Biverkningsnytt
Biverkningsarbetet år 2004
Tabell I: Åldersfördelning
Majoriteten av rapporterna gällde patienter i ål-
Ålder (år)
Antal rapporter (%)
dersgrupperna 61–80 år (28%) respektive 41–60 år
0–20
943 (23)
(25 %) (Tabell I).
21–40
646 (16)
Biverkningarnas allvarlighetsgrad och
41–60
1 029 (25)
förlopp
61–80
1 129 (28)
81–100
335 (8)
36 % av biverkningsrapporterna bedömdes innehålla
okänd
5 (<1)
allvarliga biverkningar (Tabell II). I första hand är det
Totalt
4 087 (100)
allvarliga respektive oförutsedda biverkningar som
Kommentar: I åldersgruppen 0–20 år (23 %) utgjor-
ska rapporteras.
de vaccinbiverkningar, liksom år 2003, den största
Majoriteten av patienterna (57 %) tillfrisknade utan
andelen av inrapporterade biverkningar. Könsfördel-
men, 2 % tillfrisknade med bestående men, 18 % hade
ningen i rapporterna var 60 % kvinnor och 40 % män.
ej tillfrisknat vid anmälningstillfället och i 18 % av fal-
Majoriteten av de rapporterade vaccinbiverkningarna
len var förloppet okänt. 4 % av patienterna i biverk-
är lindriga lokala reaktioner (se kommentarer till Ta-
ningsrapporterna dog och för 69 % av dessa dödsfall
bell IV och V).
kunde ett orsakssamband mellan dödsfallet och läke-
medelsreaktionen inte uteslutas (Tabell III).
Tabell II: Fördelning med avseende på allvarlighetsgrad
Sambandsbedömning
Biverkningarnas
Antal rapporter (%)
För majoriteten (91 %) av biverkningsrapporterna
allvarlighetsgrad
kan ett orsakssamband mellan läkemedlet och den
Allvarliga∗–ej dödsfall
1 320 (32)
rapporterade biverkningen
inte uteslutas. Bland bi-
Allvarliga∗ –dödsfall
166 (4), 115**
verkningsrapporter med rapporterade dödsfall har i
Ej allvarliga
2 594 (63)
69 % (115 av 166 rapporter) ett samband mellan lä-
Okänt
7 (<1)
kemedelsreaktionen och det rapporterade dödsfallet
Totalt
4 087 (100)
inte kunnat uteslutas. Detta betyder dock
inte att ett
Kommentar: * En allvarlig biverkning är en sådan
orsakssamband mellan läkemedlet och dödsfallet har
som leder till döden, är livshotande, nödvändiggör
säkerställts. Det rapporterade dödsfallet kan natur-
sjukhusvård eller förlängd sjukhusvård, leder till inva-
ligtvis vara orsakat av läkemedlet i fråga men kan även
lidisering eller medför missbildning. I 166 rapporter
vara orsakat av andra läkemedel som patienten står på,
har dödsfall rapporterats, varav i **115 av dessa rap-
kan vara orsakat av patientens bakomliggande sjuk-
porter har ett samband mellan läkemedelsreaktionen
dom eller ha uppkommit oberoende av läkemedlet.
och det rapporterade dödsfallet
inte kunnat uteslu-
tas.
Fördelningen av biverkningar på
misstänkta läkemedel
Tabell III. Biverkningarnas förlopp
Rapporter – totalt
Förloppet
Antal rap-
Läkemedel som används för att behandla infektions-
porter (%)
sjukdomar (ATC-kod J) respektive sjukdomar och
Okänt
734 (18)
tillstånd i nervsystemet (ATC-kod N) tillhörde, lik-
Tillfrisknat utan men
2 349 (57)
som år 2003, de mest inrapporterade misstänkta läke-
Tillfrisknat med bestående men
67 (2)
medlen år 2004 (Tabell IV). Vacciner mot bakteriella
Ej tillfrisknat vid anmälningsdatum
751 (18)
infektioner och virusinfektioner (inklusive kombina-
tioner) var mest frekvent förekommande bland J-lä-
Dödsfall där ett samband med läke-
115 (3)
kemedlen respektive antidepressiva läkemedel bland
medelsreaktionen inte kan uteslutas*
N-läkemedlen.
Dödsfall pga. annan orsak än läke-
51 (1)
medlet
Oklart
20 (<1)
Totalt
4 087
(100)
Kommentar: * Ett orsakssamband mellan läkemedlet
och dödsfallet kan inte uteslutas, vilket
inte betyder
att ett orsakssamband mellan läkemedlet och dödsfal-
let har säkerställts. Bland biverkningsrapporter med
rapporterade dödsfall har i 69 % (115 av 166 rappor-
ter) ett samband mellan läkemedelsreaktionen och
det rapporterade dödsfallet
inte kunnat uteslutas.
Information från Läkemedelsverket 5:2005 39
Biverkningsnytt
Biverkningsarbetet år 2004
Tabell IV. Fördelning av anmälda biverkningar under år 2004 på ATC-koder för olika läkemedel
ATC-kod
Antal misstänkta Antal misstänkta Antal misstänkta
Försälj-
läkemedel i rap-
läkemedel i rap-
läkemedel i rapporter ning
porter totalt (%) porter med allvar- med dödsfall där ett
DDD/
liga biverkningar samband med läke-
TIND **)
– inklusive döds-
medelsreaktionen inte
fall (%)
kan uteslutas (%)
J. Infektionssjukdomar
1 142 (23)
306 (16)
9 (5)
18
N. Nervsystemet
1 017 (21)
389 (20)
16 (10)
239
C. Hjärta och kretslopp
589 (12)
201 (10)
6 (4)
375
B. Blod och blodbildande
424 (9)
357 (18)
99 (59)
125
organ
L. Tumörer och rubbning-
376 (8)
229 (12)
19 (11)
9
ar i immunsystemet
M. Rörelseapparaten
366 (8)
164 (8)
9 (5)
64
A. Matsmältningsorgan
225 (5)
85 (4)
5 (3)
263
och ämnesomsättning
G. Urin- och könsorgan
193 (4)
89 (5)
3 (2)
109
samt könshormoner
V. Varia
177 (4)
51 (3)
0
0
R. Andningsorganen
139 (3)
20 (1)
0
140
D. Hud
92 (2)
15 (1)
0
253
H. Hormoner, exkl köns-
65 (1)
37 (2)
1 (<1)
39
hormoner
P. Antiparasitära, insekts-
33 (<1)
10 (<1)
0
<1
dödande och repellerande
medel
Naturläkemedel
20 (<1)
6 (<1)
0
(ingen
uppgift)
S. Ögon och öron
18 (<1)
6 (<1)
0
15
Totalt *)
4 876 (100)
1 965 (100)
167 (100)
1 650
*) Summan av antalet misstänkta läkemedel överstiger antalet biverkningsrapporter, vilket beror på att en patient
kan ha stått på flera läkemedel samtidigt.
**) DDD/TIND= Antal definierade dygnsdoser per 1000 invånare och dag
Tabell V. De mest rapporterade läkemedel totalt år 2004
Läkemedel (ATC-kod)
Antal rapporter (%)
Infanrix-Polio+ Hib (pulver); Hib-vaccin (J)
247 (6)
Waran (B)
176 (4)
DiTeBooster (J)
146 (4)
Trombyl (B)
88 (2)
Priorix (J)
70 (2)
Vioxx (M)
63 (2)*
Pentavac (J)
61 (1)
Zoloft (N)
59 (1)
Remicade (L)
51 (1)
Kommentar: Vacciner var år 2004, liksom år 2003, de mest frekvent rapporterade läkemedlen.
*Vioxx drogs på
företagets initiativ in från marknaden 2004-09-30. Under år 2004 har Vioxx angivits som misstänkt läkemedel
i 63 rapporter, varav 60 % (38/63) av dessa rapporter inkom efter 2004-09-30.
40 Information från Läkemedelsverket 5:2005
Biverkningsnytt
Biverkningsarbetet år 2004
Tabell VI. De mest rapporterade läkemedel med
B-läkemedel
allvarliga biverkningar (inklusive dödsfall) år 2004
59% (99 av 167) av de rapporterade misstänkta lä-
Läkemedel (ATC-kod)
Antal
kemedlen var läkemedel med ATC-kod
B, specifikt
rapporter (%)
läkemedel för att behandla blodproppsbildning, med
Waran (B)
146 (10)
inrapporterade blödningar (framför allt i hjärnan).
Trombyl (B)
86 (6)
Mest frekvent förekommande läkemedel var
Wa-
Vioxx (M)
44 (3)*
ran i 47 rapporter.
Trombyl, Actilyse, Rapilysin,
Remicade (L)
39 (3)
Fragmin, Klexane, Plavix, Heparin Leo, Metalyse
Zoloft (N)
23 (2)
och
Reopro och
förekom i 13, 7, 6, 5, 5, 5, 4, 3 res-
Enbrel (L)
22 (1)
pektive 2 rapporter. I flera rapporter förekom dessa
Plavix (B)
21 (1)
misstänkta antikoagulantia/trombocytaggregations-
Heracillin (J)
18 (1)
hämmande medel tillsammans med varandra och i
Klexane
17 (1)
enstaka rapporter tillsammans med Waran.
Infanrix-Polio+ Hib (pulver);
17 (1)
L-läkemedel
Hib-vaccin (J)
11% (19 av 167) var läkemedel med ATC-kod
L (im-
Methotrexate Wyeth Lederle (J)
17 (1)
munhämmande medel och cytostatiska/cytotoxiska
Kommentar: Waran, Tromyl och Vioxx var de mest
medel), vilka har kända allvarliga biverkningar och ofta
frekvent rapporterade läkemedlen i rapporter med al -
ges till patienter med svår bakomliggande sjukdom.
varliga biverkningar år 2004. Många patienter står på
I inkomna rapporter har bl.a. blod-, luftvägs- och
antikoagulantiabehandling och på kombinationer av
infektionsassocierade biverkningar inrapporterats. I
behandling med antikoagulantia och trombocytaggre-
en rapport har intrauterin fosterdöd, spontanabort i
gationshämmande medel pga. al varlig sjukdom med
vecka 30 med multipla missbildningar, rapporterats. I
risk för komplikationer i sig. *Under år 2004 har Vioxx
detta fall hade mamman medicinerat med metotrex-
angivits som misstänkt läkemedel i 44 rapporter med
at, vilket sattes ut i graviditetsvecka 12.
al varliga biverkningar, varav 66% (29/44) av dessa rap-
Methotrexate Wyeth Lederle, Xeloda, Enbrel och
porter inkom efter indragningen 2004-09-30.
Remicade förekom i 2, 2, 2 respektive 2 rapporter
vardera.
Infanrix-Polio+Hib (vaccin), Waran (antikoagulan-
N-läkemedel
tium) och diTeBooster (vaccin), i fallande ordning,
10% ( 16 av 167) var läkemedel med ATC-kod
N
var de läkemedel som förekom i flest antal rapporter
(läkemedel för att behandla sjukdomar och tillstånd i
år 2004 (Tabell V). Samtliga är läkemedel med stor
nervsystemet).
användning. I vaccinrapporterna är lindriga lokala re-
Leponex och
Clozapine Alpharma (klozapin),
aktioner de mest frekvent rapporterade biverkning-
neuroleptika för behandling av psykoser, förekom i
arna.
5 rapporter.
Rapporter med allvarliga biverkningar (inklusive
Leponex förekom i 4 rapporter.
I en rapport har
dödsfall)
njursvikt, acidos och hjärtstillestånd rapporterats.
Bland rapporter med allvarliga biverkningar (inklusive
Leponex förekom i denna rapport som misstänkt lä-
dödsfall) var läkemedel tillhörande ATC-grupperna
kemedel tillsammans med Glucophage (metformin).
N, B, J och L, liksom år 2003, de mest inrapporte-
Bedömning har gjorts att ett samband mellan döds-
rade misstänkta läkemedlen (Tabell IV). Det är t.ex.
fallet och läkemedelsreaktionen inte kan uteslutas för
antidepressiva medel, analgetika, neuroleptika (N-lä-
metformin, men kan uteslutas för klozapin. Enligt
kemedel), vacciner, antibakteriella medel för invärtes
utlåtandet är det möjligt att metformin kan ha utlöst
bruk (J-läkemedel), antikoagulantia (B-läkemedel)
en mjölksyraacidos som kan ha bidragit till förloppet
och immunhämmande medel, cytostatiska/cytotox-
genom en sekundär hyperkalemi med ökad risk för
iska medel (L-läkemedel).
hjärtarytmier.
Waran (antikoagulantium), Trombyl (trombocy-
Plötslig död, hjärtmuskelinflammation och lung-
taggregationshämmande medel) och Vioxx* (anti-
emboli har rapporterats i respektive en rapport var-
inflammatoriskt medel), i fallande ordning, var de
dera. I rapporten med inrapporterad plötslig död
läkemedel som förekom i flest antal rapporter med
förekom Leponex som misstänkt läkemedel tillsam-
allvarliga biverkningar år 2004 (Tabell VI).
mans med Cisordinol (zuklopentixol) och Cipralex
* Drogs på företagets initiativ in från marknaden 2004-09-30
(escitalopram) och bidrag av möjlig interaktion dis-
Rapporter med dödsfall där ett samband med
kuterades. Obduktionerna visade hjärtförstoring i två
läkemedelsreaktionen inte kan uteslutas
fall, varav i ett av dessa fall även omfattande hjärt-
I 115 rapporter med dödsfall, där ett samband med
muskelinflammation, och uttalad åderförkalkning i
läkemedelsreaktionen inte kan uteslutas, har 167
hjärtats kranskärl i ett fall.
misstänkta läkemedel rapporterats. I Tabell VII åter-
Clozapine Alpharma, med inrapporterad dilate-
finns misstänkta läkemedel vilka har rapporterats vid
rad kardiomyopati som dödsorsak, förekom i en rap-
mer än ett tillfälle:
port.
Information från Läkemedelsverket 5:2005 41
Biverkningsnytt
Biverkningsarbetet år 2004
M-läkemedel
Fördelningen av biverkningar på
5% (9 av 167) var läkemedel med ATC-kod
M (med-
diagnosgrupper
el för rörelseapparaten).
Vioxx (rofecoxib), ett antiinflammatoriskt medel
Fördelning av biverkningar på diagnoshuvudgrup-
med smärtlindrande och febernedsättande effekt, fö-
per visar att de mest rapporterade biverkningarna
rekom i 3 rapporter. I 2 rapporter har hjärtinfarkt
var, liksom år 2003, hudbiverkningar, allmänna sym-
rapporterats. I en rapport har koronarsjukdom rap-
tom, neurologiska biverkningar och biverkningar
porterats. Obduktionen i sistnämnda fallet visade en
från mag-tarmkanalen. Allmänna symtom innefattar
stenoserande koronarskleros och hjärthypertrofi.
många ospecifika reaktioner, t.ex. immunologiska
reaktioner, medvetanderubbning, temperatur – och
C-läkemedel
viktpåverkan. Lokal reaktion, feber, exantem, klåda
6% (6 av 167) var läkemedel med ATC-kod
C (medel
och urtikaria, i fallande ordning, var de mest frekvent
för hjärta och kretslopp).
rapporterade biverkningarna år 2004 (Tabell VIII).
Lanacrist (digitalis),
ett medel vid hjärtsjukdom,
När det gäller rapporterade
allvarliga biverkningar
förekom i 2 rapporter. I dessa rapporter har brady-
dominerade blodbiverkningar och biverkningar från
kardi, förhöjd serumkoncentration med digitalis-
mag-tarmkanalen. Blödning i hjärnan, anemi och
förgiftning och njurpåverkan/-svikt rapporterats.
angioödem (lokal ansvällning av hud eller slemhin-
I bakomliggande sjukdomshistorier fanns multipel
nor) var de mest frekvent rapporterade biverkning-
hjärtsjukdom, hjärtsvikt och förmaksflimmer. I ena
arna i rapporter som har bedömts som allvarliga. I
rapporten förekom vid sidan av digitalis även två
dessa rapporter som har bedömts som allvarliga har
urindrivande medel, furosemid och spironolakton,
antingen förloppet eller
någon av de rapporterade bi-
som misstänkta läkemedel.
verkningarna bedömts som allvarliga (Tabell IX).
Vid
dödsfall, där ett samband med läkemedelsreak-
tionen inte kan uteslutas, var 58 % av rapporterade bi-
verkningar blodbiverkningar. Cerebral blödning var
Tabell VII. De mest rapporterade läkemedel med
den mest frekvent rapporterade biverkningen som
dödsfall, där ett samband med läkemedelsreaktionen
har rapporterats i 49 % av dessa rapporter (Tabell X).
inte kan uteslutas, år 2004.
Preparatnamn
Antal
Andel
(ATC-kod)
rapporter
rapporter
(Antal dödsfall)
i %
Waran (B)
47
41
Trombyl (B)
13
11
Tabell VIII. De mest frekvent rapporterade biverkningar
Actilyse (B)
7
6
totalt år 2004
Rapilysin (B)
6
5
Biverkningsdiagnos
Antal rapporter (%)
Fragmin (B)
5
4
Lokal reaktion
369 (9)
Feber
295 (7)
Klexane (B)
5
4
Exantem
201 (5)
Plavix (B)
5
4
Klåda
163 (4)
Heparin Leo (B)
4
3
Urtikaria
139 (3)
Leponex (N)
4
3
Angioödem
121 (3)
Metalyse (B)
3
3
Illamående
113 (3)
Vioxx (M)
3
3
Smärta
102 (2)
Methotrexate
2
2
Huvudvärk
99 (2)
Wyeth Lederle (L)
Yrsel
91 (2)
Reopro (B)
2
2
Lanacrist (C)
2
2
Tabell IV. De mest frekvent rapporterade allvarliga
Xeloda (L)
2
2
biverkningar (inklusive dödsfall) år 2004
Enbrel (L)
2
2
Remicade (L)
2
2
Biverkningsdiagnos
Antal rapporter (%)
Blödning cerebral
83 (6)
Diklofenak
2
2
Anemi
58 (4)
Merck NM (M)
Angioödem
55 (4)
Kommentar: B-läkemedlen var år 2004, liksom år
Feber
51 (3)
2003, de mest frekvent rapporterade läkemedlen
Mixed liver reaktion
42 (3)
bland dödsfall där ett samband med läkemedelsreak-
GI blödning uns
40 (3)
tionen inte kan uteslutas. Blödningar är vanliga och
Anafylaktisk reaktion
39 (2)
välkända biverkningar för dessa läkemedel och vid
Lungemboli
34 (2)
behandling är det en balansgång mellan risken för
Kräkningar
31 (2)
död som komplikation till blodproppssjukdomen och
Konfusion
29 (2)
biverkning av läkemedlet.
42 Information från Läkemedelsverket 5:2005
Biverkningsnytt
Biverkningsarbetet år 2004
Tabell X. De mest frekvent rapporterade biverkningar
Återrapportering till hälso- och sjukvården
vid dödsfall, där ett samband mellan dödsfallet och
Ovanstående sammanställning med biverkningsdata
läkemedelsreaktionen inte kan uteslutas, år 2004.
för år 2004, från det nationella biverkningsregistret,
Biverkningsdiagnos
Antal rapporter
är en fortsättning på återrapporteringen till hälso-
(%)
och sjukvården, vilken utför ett viktigt arbete genom
Blödning cerebral
56 (49)
att rapportera misstänkta biverkningar. De mest rap-
Blödning subdural
5 (4)
porterade läkemedlen är läkemedel med stor använd-
Lungemboli
4 (3)
ning. Majoriteten av dödsfallen är kopplade till väl-
Njurinsufficiens
4 (3)
kända risker.
Blödning cerebellär
3 (3)
Läkemedelsverket (LV) försöker även verka för en
GI blödning uns
3 (3)
bättre biverkningsrapportering genom att uppmana
Hjärtinfarkt
3 (3)
sjukvården till ökad rapportering. Likaså pågår som
Acidos
2 (2)
tidigare en genomgripande utredning av det nuva-
Agranulocytos
2 (2)
rande rapporteringssystemet för att ta fram en för-
Asystoli
2 (2)
enklad rapporteringsrutin vilket skulle underlätta för
Benmärgsdepression
2 (2)
sjukvården.
Blödning
2 (2)
Vid sidan av spontanrapporteringen hämtas kunskap
Blödning intraabdominell
2 (2)
om misstänkta läkemedelsbiverkningar, s.k. biverk-
Blödning subarachnoidal
2 (2)
ningssignaler, även från andra källor, t.ex. periodiska
Bradykardi
2 (2)
säkerhetssammanställningar från industrin, epidemi-
Hyperglykemi
2 (2)
ologiska studier, vetenskapliga litteraturen och från
Intoxikation
2 (2)
andra medlemsländer inom EU och från WHO. Det-
Levernekros
2 (2)
Mjölksyraacidos
2 (2)
ta ger möjlighet till snabbare och mer heltäckande
Mors subita
2 (2)
bedömning av biverkningssignaler.
Mucositis
2 (2)
Läkemedelsverket ansvarar för att läkemedel ska
Myokardit
2 (2)
vara både effektiva och säkra och följas under hela sin
Pneumocystitis carcini-infektion
2 (2)
livscykel. Detta innebär åtgärder för säkerhetsuppfölj-
ning av läkemedel såväl före godkännande som under
Icke-interventionsstudier
användning i syfte att snabbt kunna identifiera signa-
98 rapporter inkom från kvalitetsregister, s.k. icke-in-
ler om misstänkta nya och allvarliga biverkningar av
terventionsstudier. I samtliga rapporter är Remicade
läkemedel samt bedöma om det eventuellt finns en
(68 %) respektive Enbrel (32 %) rapporterade miss-
ökad säkerhetsrisk och hur stor denna är.
tänkta läkemedel. 98 % (96/98) av biverkningsrap-
porterna bedömdes innehålla allvarliga biverkningar.
Sju av rapporterna gäller dödsfall, varav i fyra rappor-
ter ett samband mellan dödsfallet och läkemedelsre-
aktionen inte kan uteslutas.
Fördelning av biverkningar på diagnoshuvudgrup-
per visar att de mest rapporterade biverkningarna, i
fallande ordning, var luftvägsbiverkningar, allmänna
symtom, cirkulationsbiverkningar och infektionsas-
socierade biverkningar. Pneumoni, anafylaktisk re-
aktion och sepsis var de mest frekvent rapporterade
biverkningarna.
Information från Läkemedelsverket 5:2005 43
 Läkemedelsmonografier
Läkemedelsmonografier
Aclasta (zoledronsyra)
Infusionsvätska 5 mg/100 mL (0,05 mg zoledronsyra/mL)
ATC-kod: M05B A08
Novartis Europharm Limited
Sammanfattning
Aclasta innehåller den sedan tidigare godkända bisfosfonaten zoledronsyra. Läkemedlet har godkänts för
behandling av Pagets sjukdom. Zoledronsyra (5 mg i intravenös engångsdos) har jämförts med risedronat
(30 mg dagligen under två månader) i två studier hos patienter med Pagets sjukdom. Efter sex månader upp-
visade sammantaget 96 % av patienterna behandlade med zoledronsyra terapeutiskt svar och 89 % normali-
sering av alkaliska fosfataser i serum medan motsvarande frekvenser för risedronat var 74 % respektive 58 %
(p>0,0001). Ingen skillnad avseende förändring av svårighetsgraden av smärta framkom mellan de två läke-
medlen. Säkerhetsprofilen är den förväntade för i.v. administrerade bisfosfonater vid icke malign sjukdom.
Godkännandedatum 15 april 2005 (centrala proceduren).
Läkemedelsverkets värdering
Zoledronsyra är den tredje bisfosfonaten som har godkänts för behandling av Pagets sjukdom. Läkemedlet
har betydligt bättre effekt än risedronat och har dessutom fördelen av att det ges som en engångsdos.
Terapeutiska indikationer
etidronat och risedronat godkända för behandling av
Behandling av Pagets sjukdom.
Pagets sjukdom. Nu har även zoledronsyra godkänts
för Pagets sjukdom. Zoledronsyra är sedan tidigare
Verksam beståndsdel
(2001) godkänt under namnet Zometa för behand-
ling av patienter med tumörinducerad hyperkalcemi
samt förebyggande av skelettrelaterade händelser hos
patienter med avancerade benvävnadsmetastaser.
Klinisk effekt
Doseffektstudier
Den aktiva beståndsdelen är zoledronsyra och tillhör
Relevanta doseffektstudier avseende behandling av
substansklassen bisfosfonater.
Pagets bensjukdom saknas.
Klinik
Pivotala studier
De två pivotala studierna inkluderade män (67,8 %)
Bakgrund
och kvinnor med Pagets sjukdom. 74,2 % av patien-
Prevalensen av Pagets sjukdom anges till upp till 3 % i
terna var 65 år eller äldre. Ungefär 2/3 av patienter-
den europeiska populationen över 55 år. I Sverige är
na hade polyostotisk sjukdom och 61 % hade smärtor
den metaboliska bensjukdomen mindre vanligt före-
vid behandlingsstart.
kommande. Sjukdomen är något vanligare hos män
Utgångsvärdet av alkaliska fosfataser i serum
än hos kvinnor och karakteriseras av fokal ökning av
(ALP) var två gånger övre referensvärdet eller högre.
benomsättningen i ett (monoostotisk sjukdom) eller
Den kortaste wash-out perioden avseende tidigare
flera ben (polyostotisk sjukdom). I afficierade om-
behandling med kalcitonin och bifosfonat var 90 res-
råden ökar osteoklastaktiviteten med benresorption
pektive 180 dagar. Patienter med kreatininclearance
som följd. Denna följs av desorganiserad uppbygg-
<30 mL/minut inkluderades inte.
nad av ny benvävnad av låg kvalitet och dålig hållfast-
I den ena studien (1) ingick 172 patienter och i
het. Pagets sjukdom medför en betydande morbidi-
den andra (2) 185 patienter. De randomiserades till
tet med olika symtom som bensmärtor, patologiska
zoledronsyra (engångsinfusion av 5 mg zoledron-
frakturer, bendeformiteter, sekundär osteoartros och
syra under minst 15 minuter), respektive risedronat
dövhet. Osteosarkom är en sällsynt komplikation.
(30 mg risedronat dagligen under två månader).
Andra komplikationer inkluderar spinal stenos, in-
Primärt effektmått var andelen patienter som upp-
tern hydrocefalus och andra nervskador på grund av
nådde terapeutiskt svar definierat som normalisering
bendeformiteterna.
av ALP eller åtminstone 75 % minskning av överskot-
Läkemedelsbehandling av Pagets sjukdom bygger
tet ALP (= patientens utgångsvärde av ALP minus
på läkemedel som hämmar den ökade osteoklastiska
punktestimatet för referensintervallet) vid slutet av
benresorptionen. Sedan tidigare är bisfosfonaterna
den sjätte månaden efter behandlingsstart. Bland
44 Information från Läkemedelsverket 5:2005
Monografier
Aclasta
sekundära effektmått ingick tid till terapeutiskt svar,
av zoledronsyrapatienterna och 84,3% av risedronat-
förändring av smärtscore över tid samt förändring av
patienterna) av patienterna med terapeutiskt svar vid
CT i serum och urin. (CT är en markör för ben-
slutet av de två huvudstudierna. Efter arton månader
x
x
resorption, se nedan). En explorativ analys gjordes
förelåg bibehållet terapeutiskt svar hos 98,6 % av de
avseende andelen patienter som nådde normalise-
analyserade patienterna behandlade med zoledron-
ring av ALP över tid. I MITT- (modified intent-to
syra medan motsvarande andel var 66,4 % hos patien-
treat) analysen ingick alla randomiserande patienter
terna behandlade med risedronat.
med utgångsvärde av ALP och minst ett ALP-värde
Effekter på benomsättningsmarkörer
därefter. Denna population omfattade 97,2 % av alla
Målnivåerna vid behandling med bisfosfonater vid
randomiserade patienter.
Pagets sjukdom är referensintervallen för benomsätt-
Andelen patienter med terapeutiskt svar framgår av
ningsmarkörer hos premenopausala kvinnor. Dessa
Tabell I och andelen patienter med normalisering av
anses indikera en behandlingsintensitet som är säker
ALP vid sex månader framgår av Tabell II.
för benvävnaden.
Tid till terapeutiskt svar var signifikant kortare
Förändringarna av benmetabolismen över tid stu-
med zoledronsyra än med risedronat, 62,7 dagar
derades med två markörer för resorption, s-beta-CT
jämfört med 108,2 dagar i den ena studien och 62,7
x
(serum beta-carboxy-terminal cross-linking telopep-
dagar jämfört med 103,1 dagar i den andra. Ingen
tide of type I collagen) and u-α-CT (urine alpha-car-
signifikant skillnad uppkom avseende förändring av
x
boxy-terminal cross-linking telopeptide of type I col-
smärtscore mellan patienterna som behandlats med
lagen) och bl.a. två markörer för benformation s-ALP
zoledronsyra respektive risedronat.
(alkaliska fosfataser i serum) och s-P1NP (serum ami-
I en kombinerad analys av de två studierna fram-
no-terminal propeptide of type 1 collagen i serum).
kom att effekten av zoledronsyra var relativt konsis-
Bisfosfonatbehandlingen minskade resorptionsmar-
tent och oberoende av ålder eller kön, medan effek-
körerna tidigare än markörerna för benformation.
ten föreföll att avta något med stigande ålder hos de
Som framgår av figur 1–4 nåddes målnivåerna för alla
risedronatbehandlade patienterna (Tabell III). Ande-
fyra markörerna i genomsnitt vid behandling med
len patienter med terapeutiskt svar var oberoende av
zoledronsyra men inte med risedronat.
utgångsvärdet av ALP för de båda bisfosfonaterna.
Man har gjort en uppföljning av en del (84,6 %
Tabell I. Andelen patienter med terapeutiskt svar vid sex månader (MITT)
Studie
Behandling
n
Andel (%) Skillnad (95 % konfidensintervall
p-värde
*)
1
zoledronsyra
88
95
0,20 (0,09–0,31)
<0,0001
risedronat
89
75
2
zoledronsyra
88
97
0,23 (0,12–0,35)
<0,0001
risedronat
82
73
*) Skillnaden mellan zoledronsyra – minus risedronat.
Tabell II. Andelen patienter med normalisering av ALP vid sex månader (MITT)
Studie
Behandling
n
Andel (%)
Skillnad (95 % konfidensintervall) p-värde
1
zoledronsyra
88
89
0,32 (0,19–0,46)
<0,0001
risedronat
89
56
2
zoledronsyra
88
89
0,29 (0,15–0,43)
<0,0001
risedronat
82
60
Tabell III. Andelen (%) patienter, uppdelade i demografiska subgrupper, med terapeutiskt svar vid sex månader
(MITT). Sammantaget resultat från de två studierna.
Subgrupp
zoledronsyra
risedronat
Ålder
<65 år
100
0,82
65–74 år
97
0,78
>74 år
93
0,66
Kön
Kvinna
97
0,74
Man
95
0,75
Information från Läkemedelsverket 5:2005 45
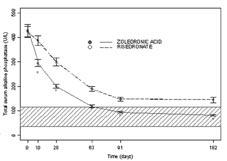
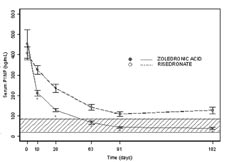
Monografier
Aclasta
Figur 1. Förändring av s- beta-CT vid behandling
Figur 4. Förändring av s-P1NP vid behandling med
x
med zoledronsyra och risedronat. (Streckat område är
zoledronsyra och risedronat. (Streckat område är
referensintervallet för s-beta-CT ).
referensintervallet för s-P1NP).
x
Säkerhetsvärdering
De vanligaste biverkningarna som bedömdes ha
samband med behandlingen med zoledronsyra var
influensaliknande symtom (11,9 %), feber (6,8 %),
huvudvärk (6,2 %), illamående (5,6 %), skelettsmärta
(4,5 %), muskelvärk (6,2 %) och ledvärk (4,0 %). De
flesta av dessa symtom debuterade inom tre dagar
efter läkemedelstillförseln och de upphörde vanligen
inom fyra dagar efter symtomdebuten. Hypokalcemi
var också vanlig och noterades hos 4,4 % (8/177, va-
rav två var symtomatiska). Dessa två patienter hade
inte tagit D-vitamin och kalcium enligt ordination.
Detta understryker vikten av att ge D-vitamin och
kalcium i tio dagar i samband med zoledronsyrabe-
Figur 2. Förändring av u-alfa-CT vid behandling
x
handling.
med zoledronsyra och risedronat. (Streckat område är
Inga njurproblem framkom i denna population.
referensintervallet för u-alfa-CT ).
x
Litteratur
1—2. Av tillverkaren tillhandahållen opublicerad dokumentation,
vilken har accepterats för publicering.
3. N Engl J Med 2005;353:898-908.
Figur 3. Förändring av ALP vid behandling med
zoledronsyra och risedronat. (Streckat område är
referensintervallet för ALP).
46 Information från Läkemedelsverket 5:2005
Monografier
Afatasol
Aftasol (amlexanox)
ATC-kod: A01A D07
Oral pasta 5 %
Meda AB
Sammanfattning
Aftasol, oral pasta, innehåller som aktiv substans amlexanox som är en oralt aktiv lipoxygenashämmare, vars
verkningsmekanism vid munsår inte är helt känd. Läkemedlet har godkänts för behandling av aftösa mun-
sår. Godkännandet baseras på en metaanalys av fyra studier omfattande totalt cirka 1200 patienter med en
behandlingstid varierande mellan 4 och 10 dygn. Enligt denna var mediantiden till ulcusläkning 4,9 dygn i
aftasolgruppen medan den var 5,6 dygn i vehikelgruppen. Motsvarande mediantider för komplett smärtfri-
het var 3,4 respektive 4,1 dygn. Båda skillnaderna var signifikanta (p<0,001).
Säkerhetsmässigt noterades lokala symtom i låg frekvens.
Godkännandedatum: 25 maj 2005 (ömsesidigt erkännande).
Läkemedelsverkets värdering
Aftasol är ett nytt läkemedel för behandling av aftösa munsår. Den kliniska effekten är marginell.
Information från Läkemedelsverket 5:2005 47
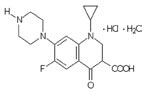
Monografier
Ciloxan
Ciloxan (ciprofloxacin)
ATC-kod: S02A A
Örondroppar, lösning 3 mg/mL
Alcon Sverige
Sammanfattning
Ciloxan är en örondroppe innehållande ciprofloxacin som godkänts för behandling av akut medelsvår till
svår extern otit. Godkännandet baseras på en studie där Ciloxan jämförs med Cortisporin, vilken innehåller
neomycinsulfat 0,35 %, polymyxin B 10 000 IU/mL och hydrokortison 1 %. Jämförbar klinisk utläkning
av infektionerna konstaterades hos patienterna med positiv odling före behandling, 96,3 % av de Ciloxan-
behandlade patienterna respektive 91 % av patienterna som behandlades med Cortisporin. Inga allvarliga
biverkningar noterades i de kliniska studierna.
Godkännandedatum: 23 juni 2005 (nationell procedur).
Läkemedelsverkets värdering
Ciloxan örondroppar innehåller ciprofloxacin och är ytterligare ett alternativ för behandling av extern otit.
Fördelar är läkemedlets antimikrobiella sprektrum omfattande
Pseudomonas aeruginosa och att användning
vid perforerad trumhinna ej är kontraindicerad.
Verksam beståndsdel
Klinik
Den aktiva beståndsdelen är ciprofloxacin. I prepara-
Bakgrund
tet föreligger ciprofloxacin som hydrokloridmonohy-
Ciprofloxacin är ett bredspektrumantibiotikum som
dratsalt. Saltet är lättlöslig i vatten.
funnits på marknaden sedan 1980-talet som tablet-
ter och i parenterala beredningsformer. Ciprofloxacin
finns även sedan tidigare i beredningsformer för of-
talmologiskt bruk i styrkan 3 mg/mL.
De antibiotikainnehållande läkemedel som hittills
funnits godkända för behandling av extern otit är alla
kombinationsprodukter som även innehåller korti-
son.
Klinisk effekt
Indikationer
Effekt och säkerhet har utvärderats i en singelblind
Akut medelsvår till svår extern otit med smärta, ödem,
(utvärderaren blindad) randomiserad multicenterstu-
erytem och vätskning från yttre hörselgången.
die omfattande 909 patienter, såväl barn som vuxna
Bakteriodling bör tas före behandlingsstart.
med måttlig till allvarlig akut extern otit med mindre
Hänsyn skall tagas till officiella riktlinjer för an-
än 4 fyra veckors symtom (1). Smärtans intensitet de-
vändning av antibiotika.
finierade otitens svårighetsgrad (måttlig – konstant
Dosering
men tolerabel smärta, allvarlig – intensiv och opå-
verkbar smärta). Utöver smärta krävdes även minst
Vuxna
lindrig svullnad av hörselgången och minst måttlig
4 droppar 2 gånger dagligen i hörselgången.
inflammation samt konstaterad ömhet vid palpation.
Barn >1 år
Patienter med icke-intakt trumhinna, mediaotit, ma-
3 droppar 2 gånger dagligen i hörselgången.
lign otitis externa, uppenbar virus- eller svamporsa-
Säkerhet och effekt hos barn under ett år har inte
kad otit exkluderades ur studien. Bakterieodling togs
studerats.
vid inklusion (se Tabell I). Patienter med positiv od-
Där öronpinne krävs för applicering kan dosen
ling med streptokocker exkluderades ur studien.
dubbleras första gången, dvs. 6 droppar för barn och
8 droppar för vuxna.
Rekommenderad behandlingstid: 7 dagar.
För att förhindra kontamination av droppspetsen
och lösningen måste man undvika kontakt mellan
spetsen och örat, hörselgången, omgivande vävnad
och andra föremål. Håll flaskan ordentligt tillsluten
när den inte används.
48 Information från Läkemedelsverket 5:2005
Monografier
Ciloxan
Tabell 1. Isolerade species i behandlingsgrupperna före terapi. Modifierade Intention-to-Treat data (MITT*).
MITT
Behandling
Ciloxan
Cortisporin
Organism
N
%
N
%
Microbacterium alconae
11
2,9
11
2,9
Microbacterium otitis
23
6
23
6
Pseudomonas aeruginosa
179
46,6
181
47,3
Staphylococcus aureus
21
5,5
22
5,7
Staphylococcus caprae
17
4,4
9
2,4
Staphylococcus epidermidis
18
4,7
23
6
* MITT = alla patienter som fick studieläkemedlet och var odlingspositiva för bakterier dag 1.
Tabell II. Klinisk och mikrobiologisk utläkning vid utvärdering dag 18. Modifierad per protokollanalys.
Klinisk utläkning
Mikrobiologisk eradikation
Behandling
Nej, n (%)
Ja, n (%)
Nej n (%)
Ja n (%)
Totalt
Ciloxan
8 (3,7)
206 (96,3)
10 (4,7)
204 (95,3)
214
Cortisporin
18 (9)
182 (91)
16 (8)
184 (92)
200
Totalt
26
388
26
388
414
Tabell III. Klinisk utläkning för CILOXAN vs CORTISPORIN utifrån pre-terapi isolat. Modifierad per protokollanalys.
MPP
Behandling
Ciloxan
Cortisporin
Utläkt
Utläkt
Nej
Ja
Nej
Ja
P-värde
Pre-terapi isolat
N
%
N
%
N
%
N
%
Pseudomonas aeruginosa 6
4,2
136
95,8
15
11,11 120
88,9
0,03
Gram positiva bakterier
5
4,5
107
95,5
18
16,7
90
83,3
<0,01
I studien jämfördes Ciloxan med två örondroppar,
Farmakodynamik och farmakokinetik
Cortisporin som innehåller neomycinsulfat 0,35%,
Ciprofloxacin uppvisar in vitro ett brett antibakte-
polymyxin B 10 000 IU/mL och hydrokortison 1 %.
riellt spektrum omfattande gramnegativa bakterier,
Den andra komparatorn var Ciprodex, innehållande
inklusive
Pseudomonas aeruginosa och grampositiva
0,3 % ciprofloxacin kombinerat med dexametason
bakterier inkluderande
Staphylococcus aureus. Ci-
0,1 %. Resultaten från Ciprodexarmen är inte inklu-
profloxacins antimikrobiella spektrum är relevant för
derade ansökan och därför ej bedömda. Placeboarm
den bakteriella flora som ligger bakom majoriteten av
saknades. Dosen av Ciloxan var 3 droppar (barn)
akuta externa otiter.
resp. 4 droppar (vuxna) två gånger dagligen medan
Cortisporin doserades 3 droppar (barn) resp. 4 drop-
Säkerhetsvärdering
par (vuxna) tre gånger dagligen. Behandlingstiden
Produkten innehåller bensalkonklorid vilket tidigare
var 7 dagar. Primär utvärderingsvariabel var klinisk
inneburit att användning vid perforerad trumhinna
svar (0-utläkt, 1-förbättring, 2-ingen förändring, 3-
varit kontraindicerat pga. av befarade ototoxicitet.
försämring), bedömt av ”blindad” utvärderare, dag
Vid studier på marsvin, när ciprofloxacin innehål-
18 (+/- 3 dagar). Patienterna värderade därutöver
lande kliniskt relevanta koncentrationer av bensal-
två gånger dagligen smärtan på en 4-gradig skala.
konklorid, administrerades bakom trumhinnan, gav
Sekundära utvärderingsvariabler var behandlande lä-
ingen signifikant toxicitet i innerörat.
kares värdering av kliniskt svar, inflammation, ödem,
Inga allvarliga biverkningar rapporterades i den
ömhet och sekretion. Även mikrobiologisk effekt
kliniska studien. En vanlig biverkan i den kliniska
utvärderades genom odling dag 18 för de patienter
studien var klåda (1,3 %), ett symtom som emellertid
som hade positiv bakterieodling med isolat vid besö-
ofta förekommer vid extern otit och därför är svår-
ket före behandling.
värderat. Den kliniska erfarenheten från användning
Med Ciloxan örondroppar läkte infektionerna ut
av ciprofloxacin såväl peroralt som parenteralt är stor
kliniskt i 96.3 % jämfört med 91.0% hos patienterna
och ingen ototoxicitet är rapporterad.
som behandlats med Cortisporin (MPP, s.k. modifie-
Litteratur
rad per protokollanalys = alla patienter utvärderbara
(1) Av företaget inlämnad dokumentation.
enligt per protokollanalys och som var odlingspo-
sitiva dag 1, se tabell 2). Skillnaden mellan Ciloxan
och Cortisporin var högre i gruppen barn 0—12 år
(98,15 % respektive 91,58 %. Mikrobiologisk utläk-
ning framgår av Tabell III.
Information från Läkemedelsverket 5:2005 49
Monografier
Hexvix
Hexvix (hexaminolevulinat)
ATC-kod: V04C X
Pulver och vätska till lösning till intravesikal användning
PhotoCure ASA
Sammanfattning
Den underliggande farmakologiska principen för Hexvix, semiselektiv uppladdning av porfyriner i tumörcel-
ler, har länge använts vid fotodynamisk terapi. Hexvix har nu godkänts för detektion av blåscancer såsom
carcinoma in situ (CIS), hos patienter med känd blåscancer eller stark misstanke om blåscancer, baserat på
t.ex. cystoskopiundersökning eller positiv urincytologi. Den kliniska dokumentationen omfattar totalt 605
utvärderbara patienter. Som komplement till standardcystoskopi med vitt ljus medger fluorescenscystoskopi
med Hexvix en förbättrad diagnostik av framför allt tunna lesioner. Systemiska biverkningar har ej noterats i
de kliniska studierna. Risken för lokala biverkningar i form av övergående kontraktioner i blåsan samt sveda
förefaller ökad. Det har inte visats att mer komplett terapi efter undersökning med fluorescenscystoskopi
leder till bättre behandlingsresultat på sikt.
Godkännandedatum: 17 september 2004 (nationellt godkännande).
Läkemedelsverkets värdering
Hexvix är det första läkemedel, med fotodynamisk verkningsmekanism, som godkänts som diagnostikum.
Effekt på klinisk handläggning av patienter har visats och storleken av denna effekt ter sig kliniskt relevant
om patienter med en hög incidens av blåstumörer undersöks. Hexvix utgör därför ett tillskott vid diagnostik
av urinblåsetumörer.
Klinik
endast i vitt ljus. I slutna kuvert gavs information om
Hexvix, hexaminolevulinat, kan användas för de-
ev. undersökning med blått ljus. Tanken var att un-
tektion av tumörer i urinblåsan. Efter instillation av
dersökande läkare då inte skulle tveka att kartlägga
Hexvix sker med viss selektivitet uppbyggnad av por-
också mindre påtagliga fynd i avvaktan på den ”be-
fyriner i tumörceller. Vid belysning med blått ljus ses
kräftande” undersökningen i blått ljus. Efter kart-
fluorescens från dessa celler. Vid cystoskopi under-
läggning biopserades alla kartlagda lesioner.
lättas då detektionen framför allt av tunna lesioner
I det ursprungliga protokollet krävdes att ”be-
som
carcinoma in situ (CIS). Detta har visats i kli-
handlingsnivån” förändrades för att utfallet skulle
niska studier som total inkluderat 605 utvärderbara
vara positivt, t.ex. från resektion enbart till resektion
patienter.
+ profylaktisk kemoterapi. Efter protokollstillägg
räckte det med att fler maligna lesioner resekterades.
Effekt
Enligt den ursprungliga definitionen påverkades
I den viktigaste av dessa studier, PC B303/01, in-
terapin i 18 % av fallen (95 % CI 12; 25 %) så att
kluderades totalt 162 patienter. Syftet var att visa att
en mer omfattande behandling gavs på grund av sant
patienter som genomgått fluorescenscystoskopi gavs
positiva fynd vid fluorescenscystoskopi. Om även fler
en mer fullständig behandling än om de endast un-
resektioner definierade positiv behandlingspåverkan
dersökts med cystoskopi med vitt ljus. Grad av ”full-
var utfallet 21 % (95 % CI 15; 29 %). Fler falskt posi-
ständig behandling” definierades efter algoritm som
tiva fynd (biopsi med ”negativ” histologi) registrera-
avspeglar behandlingsrekommendationer utgivna av
des efter fluorescenscystoskopi, 37 % mot 26 %, men
European Association of Urology. Således påverkades
detta kan inte förklara den positiva effekten. Också
utfallsmåttet endast av om lesioner upptäcktes som
vid en isolerad värdering av utfallet efter fluorescens-
förändrade behandlingen av den enskilda patienten.
cystoskopi mot utfallet vid undersökning i vitt ljus
Histologi utgjorde ”gold standard” vid klassifikation
sågs en signifikant effekt.
av lesioner. Oberoende urolog som var ”blindad” för
Också i övriga studier sågs ett positivt utfall med
typ av cystoskopi använde algoritmen för att utifrån
avseende på detektion av lesioner. Detektionsfrekven-
sjukhistoria, cystoskopifynd, etc. ange lämplig be-
sen för CIS var 50 % vid cystoskopi med vitt ljus och
handling.
95 % för cystoskopi med blått ljus. För papillära le-
Studien genomfördes som en inompatientunder-
sioner varierade frekvensen mellan 85 % och 94 % för
sökning där patienten först undersöktes med cysto-
cystoskopi med vitt ljus och mellan 91 % och 100 %
skopi med vitt ljus. Alla misstänkta lesioner kartlades.
vid cystoskopi med blått ljus. Observera att vid den-
Därefter följde undersökning med blått ljus och ny
na typ av jämförelse det ”sanna” antalet lesioner är
kartläggning. För att minska risken för systematiskt
okänt; referensen här är histologiverifierade lesioner
fel, randomiserades vissa patienter till undersökning
som detekterats med vitt och/eller blått ljus.
50 Information från Läkemedelsverket 5:2005
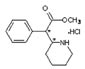
Monografier
Ritalin
Säkerhet
merad blåsa, t.ex. efter behandling med BCG, dels
Systemexponeringen efter installation av Hexvix i
pga. ökad risk för falskt positiva fynd, dels pga. en
blåsan är obetydlig och inga sannolika systemiska bi-
teoretisk risk för en cytotoxisk effekt vid belysning av
verkningar har noterats. Studiedesignen gör det svårt
porfyrinuppladdade celler.
att värdera lokaleffekterna av instillation av Hexvix i
I studierna har fluorescenscystoskopi endast an-
blåsan, men förekomsten av övergående kontraktio-
vänts vid undersökning av patienter med hög risk för
ner i blåsan samt obehag i form av brännande känsla
blåscancer och endast i samband med biopsitagning.
förefaller öka.
Inga patienter har följts med upprepade undersök-
Uppbyggnad av fluorescerande porfyriner ses ock-
ningar. Det har inte visats att mer komplett terapi ef-
så vid inflammatoriska tillstånd. Undersökning med
ter undersökning med fluorescenscystoskopi leder till
fluorescenscystoskopi bör undvikas i fall av inflam-
bättre behandlingsresultat på sikt.
Ritalin (metylfenidathydroklorid)
ATC-kod: N06B A04
Beredningsform: tabletter 10 mg respektive hårda kapslar med modifierad frisättning, 20, 30 och 40 mg.
Novartis Sverige AB
Sammanfattning
Sedan 2002 finns en depotberedning av metylfenidathydroklorid marknadsförd i Sverige för behandling av
barn med Attention Deficit Hyperactivity Disorder (ADHD) och som doseras en gång dagligen. Metylfe-
nidathydroklorid finns nu även godkänt som tablett med dosering två gånger dagligen och hård kapsel med
modifierad frisättning med dosering en gång dagligen under namnet Ritalin.
Ritalin har godkänts som en del i behandlingsprogrammet av barn över sex år och tonåringar med ADHD.
Den godkända indikationstexten betonar att farmakologisk behandling skall ges till barn med ADHD först
sedan andra behandlingsåtgärder prövats. Om behandling med metylfenidat är indicerad, skall denna ingå
som en del i ett behandlingsprogram som innefattar såväl psykologiskt som socialt stöd till barnet och dess
familj samt pedagogiska insatser i skolan.
Ritalin är ett narkotikaklassat läkemedel och förskrivningsrätten är begränsad till specialister i barn- och
ungdomspsykiatri samt barn- och ungdomsneurologi med habilitering (se LVFS 2002:7). Efter särskild
prövning kan Läkemedelsverket medge förskrivningsrätt även till läkare med annan specialistkompetens.
Godkännandedatum: 15 juni 2005 (nationell procedur).
Läkemedelsverkets värdering
Ritalintabletter och Ritalinkapslar med modifierad frisättning är ytterligare två metylfenidatläkemedel god-
kända för behandling av ADHD hos barn och tonåringar. Godkännandet av Ritalintabletter ger tillgång till
en beredningsform som underlättar finjustering av metylfenidatdosen.
Verksam beståndsdel
Ritalin finns tillgänglig i två beredningsformer, hårda
Den verksamma beståndsdelen i Ritalin är metylfeni-
kapslar med modifierad frisättning och tabletter med
dat i form av hydrokloridsaltet. Metylfenidat är kiral
direkt frisättning. Den modifierade frisättningen hos
och kan teoretiskt föreligga som fyra stereoisomerer,
kapslarna uppnås genom kombination av två olika ty-
ett
erythro- och ett
threo-enantiomerpar. I Ritalin in-
per av dragerade korn, en typ som ger direkt frisätt-
går racematet av
threo-metylfenidat. Metylfenidathy-
ning och en typ som ger fördröjd frisättning.
droklorid är lättlöslig i vatten och metanol, löslig i
Klinik
etanol och svårlöslig i aceton och kloroform.
Farmakokinetik
Ritalin kortverkande tablett absorberas snabbt och
maximal plasmakoncentration uppnås efter en till två
timmar. Halveringstiden i plasma är cirka tre tim-
mar.
Ritalin kapslar med modifierad frisättning innehål-
Metylfenidathydroklorid
ler två typer av läkemedelsinnehållande korn. Efter
Information från Läkemedelsverket 5:2005 51
Monografier
Ritalin
oral administrering fås två koncentrationstoppar, en
beredningsformer/dosvarianter av metylfenidat med
efter cirka en till två timmar och en andra topp efter
modifierad frisättning. Effekten utvärderades med
fem till sju timmar. Beredningsformen medger dose-
SKAMP (skattningsskala enl Swanson, Kotkin, Agler,
ring en gång dagligen. Kapseln kan delas och inne-
M-Flynn & Pelham) och Math Test där metylfenidat
hållet strös över och intas med mindre mängd kall
dubbelblint jämfördes med placebo. SKAMP utvär-
föda.
derar uppmärksamhet (attention) och uppförande
Efter peroral administrering av radioaktivt märkt
(deportment) medan Math Test mäter antalet pro-
metylfenidat utsöndras cirka 90 % i urinen och 1–3 %
blemlösningsförsök respektive korrekta lösningar.
i faeces som metaboliter inom 48-96 timmar. Endast
Primär utvärderingsvariabel var AUC för uppmärk-
små mängder av ometaboliserat metylfenidat (<1 %)
samhetspoäng i SKAMP. Resultat se Tabell I.
återfinns i urinen.
Studien visar att en dos Ritalin med modifierad fri-
Klinisk effekt
sättning i doserna 17,5; 20 och 25 mg effektivt för-
Godkännandet av Ritalintabletter stöds av bibliogra-
bättrade uppmärksamhet och uppförande och ökade
fiska data (1–7). En review-artikel från 1977 presen-
den kognitiva förmågan såväl morgon som eftermid-
terar 57 studier, de flesta dubbelblinda och 36 place-
dag.
bokontrollerade avseende substansen metylfenidat på
I den andra studien (9) ingick 137 barn med
indikation ADHD enligt kriterier beskrivna i DSM-
ADHD (DSM-IV). Medelåldern var 8,9 år. Efter
III eller DSM-III-R. Sjuttiofem procent av de hy-
en veckas washout titrerades Ritalin individuellt till
peraktiva barnen som behandlades med metylfenidat
10 mg/dag (n=3), 20 mg/dag (n=15), 30 mg/dag
förbättrades på kort sikt. Publicerade studier där me-
(n=14), eller 40 mg/dag (n=33), dosering en gång
tylfenidats effekter på kognitiv förmåga och beteende
dagligen i två veckor. Effekten utvärderades med
studerats och där effekten jämförts med beteendete-
Conners ADHD-skala för lärare (CADS-T) och
rapi upp till 14 månader ingår i bedömningen.
föräldrar (CADS-P). Båda skalorna inkluderar to-
Godkännandet av Ritalina hårda kapslar med mo-
talt 18 punkter från DSM-IV (ouppmärksamhet 9,
difierad frisättning stöds förutom av ovanstående
överaktivitet/impulsivitet 9) (se resultat i Tabell II).
bibliografiska data av två produktspecifika studier (ref
Därutöver användes Clinical Global Inpression of
8,9).
Improvement Scale. Primär utvärderingsvariabel var
I den första studien (8) ingick 34 skolbarn med
totalpoäng för CADS-T och delpoäng för ouppmärk-
ADHD. Studien, en enkeldos crossover studie, ut-
samhet och hyperaktivitet/impulsivitet.
värderade effekt och farmakokinetisk profil av fyra
Tabell I. SKAMP och Math Test scores. Medel-AUC värden; ITT population 34 barn med ADHD. (Protocol 02).
AUC variabel
Ritalin
Ritalin
Ritalin
Ritalin
Placebo
berenings- berednings- berednings- berednings-
form 1
form 1
form 1
form 2
17,5 mg
20 mg
25 mg
20 mg
SKAMP-Uppmärksamhet
16,8
16,7
15,7
16,7
19,8
(0-9 timmar)
SKAMP-Uppmärksamhet
6,6
6,7
6,6
6,3
8,2
(0-4 timmar)
SKAMP-Uppmärksamhet
10,2
10,1
9,2
10,4
11,6
(4-9 timmar)
SKAMP-Uppförande
16,6
16,0
13,8
15,9
22,8
(0-9 timmar)
SKAMP-Uppförande
5,8
5,9
5,4
6,1
9,6
(0-4 timmar)
SKAMP-Uppförande
10,8
10,1
8,4
9,8
13,4
(4-9 timmar)
Math Test försök
1172,4
1200,1
1183,7
1147,4
808,3
(0-9 timmar)
Math Test korrekt
1134,6
1171,5
1150,3
1101,1
777,6
(0-9 timmar)
52 Information från Läkemedelsverket 5:2005
Monografier
Ritalin
Tabell II. Förändring från grundvärde, ITT population, LOCF
n
Ritalin
n
Placebo
p-värde
Medelförändring (SD)
Medelförändring (SD)
CADS-T (primär variabel)
Totalt
62
10,7 (15,7)
70
-2,8 (10,6)
<0,0001
Ouppmärksamhet
62
5,3 (8,25)
70
-1,5 (5,67)
<0,0001
Hyperaktivitet/impulsivitet
62
5,4 (7,95)
70
-1,3 (5,93)
<0,0001
CADS-P
Totalt
63
6,3 (13,5)
70
0,5 (13,55)
<0,05
Ouppmärksamhet
63
2,8 (7,28)
70
0,2 (6,4)
<0,03
Hyperaktivitet/impulsivitet
63
3,5 (6,87)
70
0,3 (7,66)
<0,002
Studierna ger stöd för att Ritalin med modifierad fri-
Referenser:
sättning har effekt vid behandling av skolbarn med
1. Barkley RA: A review of stimulant drug research with hyperac-
ADHD.
tive children. J Child Psychol Psychiat 1977;18:137–65.
2. Klein RG: Clinical efficacy of methylphenidate in children and
Säkerhet
adolescents. Encéphale 1993;19:89–93.
3. Klein RG, Wender PW: The role of methylphenidate in psy-
Mest rapporterade biverkningar i studierna var hu-
chiatry. Arch Gen Psychiatry 1995;52:429–33.
vudvärk (11,8 %), sömnsvårigheter (9,3 %) och buk-
4. MTA Cooperative Group: A 14-month randomized clinical
smärta (6,8 %). Nedsatt aptit förekom i 6,8 % och
trial of treatment strategies for attention-deficit/hyperactivity
disorder. Arch Gen Psychiatry 1999a;56:1073–86.
längd- och viktsutvecklingen bör därför följas hos
5. MTA Cooperative Group: Moderators and Mediators of tre-
barn som behandlas med metylfenidat. I studierna
atment response for children with attention-deficit/hyperacti-
avbröts behandlingen pga. biverkningar hos 4,3 % av
vity disorder. Arch Gen Psychiatry 1999b;56:1088–96.
barnen.
6. Shaywitz SE, Shaywitz BA: Attention deficit disorder: Diag-
nosis and role of Ritalin in management. Eds LL Greenhill,
BB Osman. Liebert;1991:45–67.
7. Sprague RL, Sleator EK: Methylphenidate in hyperkinetic
children: differences in dose effects on learning and social be-
havior. Science 1977;198:1274–6.
8. Av företaget inlämnad opublicerad studie.
9. Biederman J et al. Pediatr. Drugs, 2003:5(12):833–42.
Information från Läkemedelsverket 5:2005 53
Monografier
Velcade
Velcade (bortezomib)
ATC-kod: L01X X32
Pulver till injektionsvätska, lösning 3,5 mg
Janssen-Cilag
Sammanfattning
Velcade är en proteasomhämmare, för behandling av patienter med progredierande multipelt myelom som är
tidigare behandlade med åtminstone en cytostatikaregim och inte är kandidater för benmärgstransplatation.
I en okontrollerad öppen studie inkluderande 202 patienter med progredierande multipelt myelom ef-
ter upprepade kurer med cytostatika undersöktes sjukdomsrespons med känsliga utfallsmått. Total respons
(innefattande komplett remission, partiell och minimal respons) var 35 % varav komplett remission uppnåd-
des i 4 % av fallen. Medianöverlevnaden var 17 månader, vilket var väsentligt längre än den förväntade för
denna grupp av tungt förbehandlade patienter. Effekten har också utvärderats i en jämförande studie inklu-
derande 669 patienter i olika skeden av sjukdomsutveckling och som varit exponerade för minst en cytosta-
tikaregim. De goda effekterna av behandling med Velcade kunde konfirmeras jämfört med behandling med
högdos Dexametason (Dex). Mediantiden till progress av sjukdomen var 6,2 månader med Velcade och 3,5
månader med Dex (Hazard ratio 0,55; p<0,001). Responsfrekvensen i gruppen som fått Velcade var 43 %
hos patienter som tidigare fått mer än en cytostatikaregim, respektive 52 % hos dem som fått endast en sådan.
Komplett remission uppnåddes hos 6 % av patienterna i båda grupperna.
De vanligaste biverkningarna av Velcade är illamående, diarré, förstoppning, trötthet, perifer neuropati,
kräkningar, feber och trombocytopeni. I den jämförande studien var frekvensen allvarliga biverkningar och
andelen behandlingsavbrott pga. biverkningar något högre med Velcade än med Dex.
Godkännandedatum: 26 april 2004 (centrala proceduren).
Läkemedelsverkets värdering
Velcade är den första proteasomhämmaren för behandling av cancer. Velcade utgör ett värdefullt tillskott
av en verksam terapi, vilken innebär en ny farmakologisk princip, för behandling av multipelt myelom, ett
tillstånd där behovet av fler terapuetiska möjligheter länge varit stort.
Verksam beståndsdel
Dosering
Den verksamma beståndsdelen bortezomib (Fig. 1)
Rekommenderad startdos av bortezomib är 1,3 mg/
är en potent hämmare av proteasomkomplexet i cel-
m2 kroppsyta 2 gånger i veckan under 2 veckor (dag
ler. Läkemedlet är en trimer av ”Boronic acid” som är
1, 4, 8 och 11) följt av en 10 dagars viloperiod (dag
ett derivat ur aminosyrorna leucin och fenylalanin.
12–21). Denna treveckorsperiod utgör en behand-
lingscykel.
Figur 1. Strukturformel Velcade (bortezomib).
Det rekommenderas att patienter som uppnår kom-
plett remission får ytterliggare två behandlingscykler
av Velcade efter att behandlingssvaret bekräftats. Det
rekommenderas också att patienter som svarar på be-
handlingen men inte uppnår komplett remission er-
håller totalt 8 behandlingscykler av bortezomib.
Klinik
I det kliniska utvecklingsprogrammet för Velcade har
effektutvärdering gjorts i flera solida tumörsjukdo-
mar samt blodsjukdomar. Den sjukdom som utval-
des för registreringsansökan är multipelt myelom, på
basis av mycket lovande data redan i fas II hos tungt
Indikationer
förbehandlade patienter. Resultaten har sedermera
Velcade är indicerat som monoterapi för behandling
konfirmerats av data från en jämförande fas III-studie
av progressivt multipelt myelom, hos patienter som
i en bredare patientpopulation.
tidigare har fått minst en behandling och som redan
Bakgrund
har genomgått eller är olämpliga för benmärgstrans-
Multipelt myelom är en B-cellssjukdom där tumörcel-
plantation.
lerna utgörs av plasmaceller. Det är den näst vanligase
hematologiska maligniteten efter non-Hodgkinlym-
fom. I Sverige har vi cirka 450 nya fall/år. Sjukdomen
54 Information från Läkemedelsverket 5:2005
Monografier
Velcade
leder till progredierande morbiditet karaktäriserad av
ring av effekt och även säkerhetsdata. Då utfallet be-
infektionskänslighet, skelettdestruktion, anemi och
träffande TTP var längre, 6,2 månader jämfört med
njurfunktionsstörningar. Överlevnad från diagnos är
3,5 månader, och höggradigt signifikant (p<0,0001)
sex till tolv månader utan behandling, vilket ökar till
avbröts fortsatt inklusion i kontrollarmen och alla pa-
tre år med cytostatikabehandling. Standardbehand-
tienter erbjöds behandling med Velcade, även de som
lingen initialt utgörs av melfalan i kombination med
inte progredierat. Effekt på överlevnad (Hazard ratio
kortikosteriod. Därefter ges vanligen andra alkyleran-
0,57; 95 % CI 0,40–0,81; p=0,0013) observerades
de cytostatika och antracykliner i olika kombinatio-
också. En konsekvens av att studien bröts är att upp-
ner, även med andra cytostatika och steroider. Hög-
följningstiden för överlevnad är mycket kort och data
doskemoterapi med autolog stamcellstransplantation
därmed omogna (135 dödsfall hade inträffat).
ger en överlevnadsvinst jämfört med konventionell
Effektdata presenteras översiktligt i Tabell I.
kemoterapi. Interferon har visat viss effekt. En an-
Andelen kvinnor i studien var 40 % vilket reflekte-
nan ny behandlingsstrategi utgörs av talidomid. Alla
rar prevalens av sjukdomen.
patienter blir så småningom refraktära och föremål
för palliativa insatser. Förväntad överlevnad för dessa
Farmakodynamik och farmakokinetik
patienter är sex till nio månader. Det är angeläget
Velcade är en potent hämmare av proteasomkomplex-
med ny effektiv behandling mot denna förhållandevis
et 26S i celler. Detta sker genom att den proteolytiska
vanliga blodsjukdom med dålig prognos.
aktiveringen av proteasomen specifikt inhiberas vil-
Klinisk effekt
ket resulterar i en minskning av cellens förmåga till
Fas II-studier: Godkännandet initialt grundade sig på
proteolys vilket i sin tur påverkar olika signalkaskader
behandlingsutfallet i öppna, icke jämförande multi-
i cellen, resulterande i apoptos dvs. tumörcellsdöd.
centerstudier (Ref. 1 och 2). Dosvalet grundade sig
Proteasom-hämningen påverkar tumörcellerna ge-
på maximalt tolerabel dos (MTD) och valet av be-
nom att direkt påverka cellcykelprogression och ak-
handlingschema grundade sig på effektdata från fas I.
tivering av Nuclear Factor kappa B (NF-κB) som är
Patienterna var tungt behandlade med cytostatika och
en transkriptionsfaktor central i processer som celltill-
resistenta i meningen att sjukdomen progredierade
växt, cellöverlevnad, angiogenes och metastasering.
under den senaste behandlingen (91 % av patienterna),
Prekliniska studier visar att Velcade binder selek-
alternativt kort efter initial respons. Totalt ingick 202
tivt och reversibelt till proteasomens katalytiska del
patienter som i 98 % av fallen exponerats för minst två
och att dess interaktion med diverse cellyte- repektive
behandlingsalternativ (inkluderande steroider, alkyle-
steroidhormonreceptorer är begränsad. Den proapo-
rare, antracyklin och/eller talidomid) och i 66 % fått
ptotiska effekten på tumörceller har demonstrerats i
alla fyra. I stor utsträckning hade patienterna dessut-
åtskilliga publicerade studier. Effekt på tumörer har
om fått högdosbehandling med efterföljande autolog
visats i flera
in vivo-modeller inklusive xenograft på
stamcellstransplantation (64 %). Behandlingseffekt i
råttor.
form av respons, innefattande fullständig remission,
Man har utvecklat ett dynamiskt test där graden av
partiell och minimal respons, var primär effektva-
proteasomhämning kan mätas hos patienter. Det har
riabel. Sammantaget sågs ett behandlingssvar hos
använts som stöd för doseskalering, men resultaten
35 % av patienterna och komplett remission uppnåd-
är delvis svårtolkade och traditionella metoder för att
des i 4 % av fallen. Känsliga utfallsmått innefattande
utvärdera toxicitet har använts för dosval grundat på
immunofixationsteknik för att konfirmera komplett
principen ”more is better”.
respons (Blade kriterier) användes. Medianöverlev-
Farmakokinetiken hos människa är bristfälligt un-
naden var 17 månader. En översikt av effektdata pre-
dersökt, men PK-data skall ha insamlats i fas III-stu-
senteras i Tabell I.
dien. Det finns inga data från särskilda populationer
Fas III-studie: En randomiserad, jämförande stu-
såsom kvinnor, barn eller äldre. Man beskriver på ba-
die mot högdos dexametason (Dex), inkluderande
sis av begränsad provtagning av ett fåtal patienter en
669 patienter har utförts (Ref. 3). Dessa patienter
tvåkompartmentmodell. Den snabba distributions-
hade multipelt myelom som progredierat efter 1–3
fasen har en halveringstid på 10 minuter och elimi-
tidigare behandlingar. Doseringen i de två behand-
nationsfasen har en varierande halveringstid på 5–15
lingsarmarna presenteras i Tabell I. Av patienterna
timmar. Exponering tycks vara dosproportionell i in-
i studien hade 98 % exponerats för steroider, 91 %
tervallet 1,45–2 mg/m2. Vid upprepade doser mins-
för alkylerare, 77 % för antracyklin och 49 % för ta-
kar clearance och man har sett att halveringstiden
lidomid. Högdoskemoterapi med efterföljande stam-
förlängts från 5,45 till 19,7 timmar mellan första och
cellstransplantation eller annan rescue hade givits till
tredje dosen i den första behandlingscykeln. Protein-
68 % av inkluderade patienter. Primär effektvariabel
bindningsgraden har studerats
in vitro och är 83 %.
var tid till sjukdomsprogression (TTP). En prospek-
Elimination har endast studerats
in vitro och man har
tivt definierad interimsanalys var planerad efter att
funnit att CYP3A4 och CYP2C19 svarar för huvud-
hälften av händelserna (progress) inträffat. En obe-
delen av metabolismen av bortezomib. Detta innebär
roende styrkommitté var utsedd för denna utvärde-
en interaktionspotential som inte är utredd. Kombi-
Information från Läkemedelsverket 5:2005 55
Monografier
Velcade
Tabell I. Sammanfattning av behandlingsresultaten i studierna (ITT-analys).
Fas III
Fas III
Fas III
Fas II
Alla patienter
1 tidigare
>1 tidigare
>2 tidigare
behandling
behandling
behandlingar
Tidsrelaterade hän- Velcade Dex
Velcade
Dex
Velcade
Dex
Velcade
delser
N=333
N=336 N=132
N=119
N=200
N=217
N=202
(ITT-population)
Tid till progress
189*
106*
212
169
148*
87*
210
(dagar)
Ettårsöverlevnad (%)
80**
66**
89
72
73
62
60
Bästa svar
Velcade
Dex
Velcade
Dex
Velcade
Dex
Velcade
(population med mät- N=315
N=312 N=128
N=110
N=187
N=202
N=193
bar sjd och som fått
minst 1 behandling)
CR med negativ im- 6*
<1*
6
2
6
0
4
munofixation (%)
CR med positiv im- 13*
2*
13
4
13
<1
10
munofixation (%)
CR alla + PR (%)
38*
18*
45
26
34*
13*
27
Total respons (CR + 46
35
52
41
43
31
35
PR + MR) (%)
* p<0,0001
** p=0,003
nation med läkemedel som inhiberar eller inducerar
Andelen patienter som behövde sjukhusvård pga.
de ovan nämnda enzymerna bör undvikas och i de fall
biverkningar och behandlingsrelaterade dödsfall var
detta inte går måste det ske med iakttagande av sär-
desamma för båda behandlingarna. Den allvarligaste
skilda försiktighetsmått. Bortezomib är självt en svag
toxiciteten under behandling med Velcade utgörs av
hämmare
in vitro. Endast en mycket liten del oför-
trombocytopeni, perifer neuropati, diarré och trött-
ändrat läkemedel återfinns i urin och inget i galla eller
het (30/8/7/6 % Grad 3–4). Trombocytopenin är
feces. Velcade är inte substrat för multidrogresistens
cyklisk och reversibel efter avbrytande av behandling
(MDR)-effluxproteiner.
med Velcade, medan regress av perifer neuropati
Försiktighet rekommenderas vid nedsatt njur- och
skedde i 51 % av fallen av Grad 2–4. Intressant att
leverfunktion i avsaknad av studier. Velcade är kon-
notera är att frekvensen herpes zosterinfektioner var
traindicerat vid svår leverfunktionsnedsättning. Före-
13 % hos patienter som fått Velcade, jämfört med 5 %
taget har åtagit sig att utföra PK-studier där patienter
hos dem som fått Dex. Biverkningsprofilen var lik-
med normal njur- respektive leverfunktion jämförs
artad hos 63 patienter som fått förlängd behandling
med dem som har olika grad av njur- och leversjuk-
inom ramen för en extensionsstudie.
dom.
Litteratur
Säkerhetsvärdering
1. Richardson PG and Barlogie B et al. A phase 2 study of
bortezomib in relapsed, refractory myeloma. N Engl J Med
Totalt 663 patienter (varav 331 fått Velcade) i fas
2003;348:2609–17.
III-studien fick minst en behandling och inklude-
2. Richardson PG and Barlogie B et al. Survival, duration of re-
sponse, and time to progression with bortezomib in patients
rades i underlaget för utvärdering av säkerhet. De
with relapsed and refractory multiple myeloma: an update
vanligaste biverkningarna var illamående, diarré,
with additional follow-up. Hematol J 2004;5:Suppl 2:S103–
förstoppning, trötthet, perifer neuropati, kräknin-
104. Abstract.
gar, feber och trombocytopeni. Säkerhetsprofilen
3. Richardson PG and Sonneveld P et al. Bortezomib or high-
dose dexamethasone for relapsed multiple myeloma. N Engl J
överensstämde väl med tidigare data från fas I–II.
Med 2005;352:2487–98.
I den jämförande studien var frekvensen allvarliga
4. Till Läkemedelsverket inlämnad dokumentation från företaget.
biverkningar (Grad 3–4 i 77 respektive 60 %) och
5. Se även European Public Assessment Report för Velcade på
andelen behandlingsavbrott pga. biverkningar (37
Emea:s hemsida, www.emea.eu.int.
repektive 29 %) högre med Velcade än med Dex.
56 Information från Läkemedelsverket 5:2005
Veterinärmedicinska läkemedel
Atopica vet. (ciklosporin)
ATC-kod QL04A A01
Kapslar, 10, 25, 50 och 100 mg
Novartis
Sammanfattning
Atopica innehåller ciklosporin som är en immunsuppresiv substans för behandling av svåra fall av atopisk
dermatit hos hund. Effekten av behandlingen bedömdes som jämförbar eller något bättre än den av metyl-
prednisolon i underhållsdos. Bieffekter ses i ca 30 % av fallen. Det vanligaste är lindring påverkan på mag/
tarmkanalen men även förändringar i hud och munslemhinna har rapporterats. Dessutom föreligger en risk
för att latenta infektioner ska blossa upp. Så snart atopin är under kontroll bör behandling med lägsta möjliga
underhållsdos eftersträvas. Behandling ges då varannan till var fjärde dag. Försiktighet bör iakttas vid samti-
dig behandling med andra läkemedel.
Godkännandedatum: 14 januari 2005 (proceduren för ömsesidigt erkännande).
Läkemedelsverkets värdering
Atopica är det första immunosuppressiva läkemedlet vid sidan om glukokortikoider som godkänts till hund.
Effekten vid långtidsbehandling är god. På grund av biverkningsmönstret så bör Atopica reserveras för pa-
tienter med svår atopisk dermatit, framför allt fall där glukokortikoider inte ger önskat resultat eller leder till
oacceptabla bieffekter.
Verksam beståndsdel
traktion framför allt i njuren vilket leder till försämrad
Den aktiva beståndsdelen ciklosporin är en cyklisk
glumerulär filtration. Därför kan den njurtoxiska po-
peptid som isolerats ur svampen
Beauveria nivea.
tentialen hos t.ex. aminoglykosider öka vid samtidig
Ciklosporin är svårlöslig i vatten men den är lättlöslig
behandling. Behandling med ciklosporin kan även
i organiska lösningsmedel samt lipider.
förvärra diabetestillstånd genom att substansen ger
minskad insulinfrisättning vilket kan leda till mild hy-
Indikation
perglykemi. Gingivahyperplasi liknande det som ses
Behandling av kroniska manifestationer av atopisk
vid infektion med papillomavirus har setts hos hund
dermatit.
som behandlats med höga doser och denna effekt
antas vara en virusoberoende reaktion från immun-
Farmakologi
försvaret.
Ciklosporin är en substans med omfattande im-
Ciklosporin absorberas snabbt efter oral adminis-
munsuppresiva egenskaper. Bland annat påverkas
trering med en biotillgänglighet på cirka 35 %. Va-
mastcellernas funktion såväl när det gäller antal/
riabiliteten ökar betydligt om läkemedlet ger i sam-
överlevnad som sekretion av t.ex. histamin. Även
band med utfodring varför det rekommenderas att
funktionen hos eosinofiler och lymfocyter påverkas
man ger Atopica på morgonen, helst ett par timmar
t.ex. genom att frisättningen av cytokiner hämmas
före utfodring. Vissa hundar har dock lättare att tåla
och keratinocyternas förmåga till cytokinsekretion
medlet om det ges tillsammans med foder. I sådana
reduceras. Aktiveringen av lymfocyter hämmas på ett
fall kan dosen behöva höjas något för att kompensera
tidigt stadium. Olika subtyer av T- och B-lymfocyter
för det sämre upptaget. Ciklosporin metaboliseras via
är olika känsliga. Effektorfunktionen hos aktiverade
cytokrom P450 3A4 och transporteras aktivt via P-
cytotoxiska T-lymfocyter påverkas inte och inte heller
glykoproteiner. Därför finns det ett antal läkemedel
differentieringen av alloantigenaktiverade suppressor
med vilka kliniskt relevanta läkemedelsinteraktioner
T-celler. Ciklosporin minskar även antalet Langer-
kan komma att uppstå. Av de substanser som ofta
hanska celler i epidermis och hämmar dessa cellers
används i samband med hudåkommor bör försiktig-
förmåga att aktivera lymfocyter. Fagocyterande celler
het iakttas vid samtidig behandling med bland annat
påverkas däremot inte.
erytromycin, ivermektin, milbemycin, moxidectin,
Förutom påverkan på immunsystemet ses även
itrakonazol och ketokonazol.
kardiovaskulära effekter. Ciklosporin orsakar kärlkon-
Information från Läkemedelsverket 5:2005 57
Veterinärmedicinska läkemedel
Atopica vet.
Klinisk effekt
förekommer. Biverkningsfrekvens och svårighetsgrad
Det kliniska effekten är undersökt i studier där sam-
är därmed jämförbar med dem som uppkommer ef-
manlagt ca 300 hundar ingick. Som kriterium för
ter behandling av glukokortikoider (dock med en
att bedöma effekten användes en standardskala som
annan biverkningsprofil). En intressant bieffekt som
beskriver kliniska tecken (CADESI, canine atopic
många upplever som positiv, är att många hundar får
disorder extent and severity index). För att ingå i
ökad hårväxt genom att hårfolliklarna synkroniseras i
studierna skulle hundarna ha minst tre av fyra major
tillväxtfas. Efter en initial fällningsperiod kan därför
Willemse criteria och minst två av fem minor criteria
pälskvaliteten förbättras avsevärt. Infektioner kan upp-
samt vara positiva vid allergitest. I den pivotala fält-
komma under behandlingen som följd av ciklospori-
studien ingick 176 hundar av olika raser från olika
nets immunsupressiva egenskaper. Det är viktigt att
länder i Europa (Sverige var inte representerat). Ef-
behandla eventuella infektioner/parasitinfestationer
fekten av Atopica jämfördes med den av metylpred-
innan behandlingen med Atopica inleds för att undvi-
nisolon 0,5-1 mg/kg (nedtrappat till underhållsdos).
ka att pågående infektioner förvärras. Levande vacci-
Vid första återbesöket efter fyra veckor sågs effekt i
ner ska inte användas under en tvåveckorsperiod före
båda grupperna. Det genomsnittliga CADESI-vär-
eller efter behandling.
det hade minskat från ca 70 till 40 i såväl testgrup-
I en studie med 24 hundar undersöktes säkerhe-
pen som kontrollgruppen. Vid uppföljning efter
ten vid kombinationsbehandling med en glukokor-
åtta veckor hade de ciklosporinbehandlade djuren i
tikoid (metylprednisolon, 1 mg/kg). De bieffekter
medeltal värdet 29 medan kontrollerna hade 39. Vid
som uppkom var av samma slag som de som ses vid
slutkontroll efter 16 veckor bedömde 75 % av ägarna
ciklosporin-behandling som monoterapi. Kombina-
att behandlingsresultatet för hundarna i testgruppen
tionsbehandling med glukokortikoider kan rekom-
var utmärkt eller gott. Motsvarande siffra för kontrol-
menderas i fall där bieffekterna är oacceptabla med
lerna var 60 % vilket är signifikant lägre. Siffrorna ska
de doser av endera läkemedlet som krävs för kontroll
dock bedömas med försiktighet eftersom studien inte
av atopin.
var blindad. Effekten var inte lika god i gruppen med
Säkerheten hos avelshannar och hos dräktiga och
säsongsmässig atopi.
lakterande tikar är inte undersökt. Ciklosporin pas-
Under perioden efter fyra veckor sänktes dosen
serar placentabarriären och utsöndras via mjölk i så
av Atopica till en underhållsnivå. Det visade sig att
höga koncentrationer att det kan påverka valparna.
nedtrappning till längre doseringsintervall gav bättre
Det finns dock ingen känd risk för foster.
effekt med färre biverkningar jämfört med nedtrapp-
Prekliniska studier i gnagare visar att ciklosporin
ning av den dagliga dosen. Det rekommenderas där-
inte är någon genotoxisk substans. Ciklosporin kan
för att Atopica ges försöksvis varannan eller till och
dock agera som en promotor och därmed indirekt ge
med var tredje eller var fjärde dag när den akuta sjuk-
ökad risk för uppkomst av tumörsjukdomar. Därför
domsfasen är under kontroll.
ska Atopica inte användas till patienter med tumör-
sjukdomar.
Säkerhetsvärdering
Litteratur
De vanligaste bieffekterna är kräkningar och diarré,
Av företaget insänd dokumentation.
oftast lindrigt och övergående, vilket rapporterats i
cirka 30 % av fallen i de kliniska studierna. Även gingi-
vahyperplaci, hyperkeratos och vårtliknande lesioner
58 Information från Läkemedelsverket 5:2005
Veterinärmedicinska läkemedel
Equilis StrepE
Equilis StrepE (vacccin mot Streptococcus equi)
ATC kod: QI05A E
Pulver och vätska till injektionsvätska (suspension)
Intervet
Sammanfattning
Equilis StrepE är ett levande vaccin som reducerar de kliniska tecknen vid
Streptococcus equi-infektion (kvar-
ka). Effekten består i att djur som utsätts för naturlig smitta får en infektion med subkliniskt förlopp. Ef-
fekt av vaccinet ses i cirka 75 % av fallen och är visad upp till tre månader efter grundvaccination med två
injektioner. Vid upprepad vaccination inom sex månader ges en injektion. Vaccination ger i sig en lindrig,
övergående infektion.
Godkännandedatum: 10 maj 2004 (centrala proceduren).
Läkemedelsverkets värdering
Equilis StrepE är det första vaccinet mot
Streptococcus equi-infektion hos häst som marknadsförs i Sverige.
Eftersom vaccinet i sig ger upphov till en lindrig infektion och inte skyddar mot naturlig smitta utan bara
begränsar de kliniska tecknen är Equilis StrepE olämpligt att använda för rutinmässig vaccination. Vaccinet
har ett värde bara i de fall där man befarar att en häst kommer att utsättas för en mycket stor smittrisk upp
till tre månader efter vaccination.
Indikation
tarna. Vid revaccination efter upp till sex månader
För immunisering av häst mot
Streptococcus equi för
efter grundvaccination behöver bara en injektion ges.
att reducera kliniska tecken och förekomst av bölder
Vaccinationen är inte effektiv om den utförs under
i lymfkörtlar.
pågående utbrott.
Equilis StrepE är inte avsett för rutinvaccinering
Kunskapen om Equilis StrepE använt under fält-
mot kvarka utan enbart godkänt för användning i
förhållanden är mycket begränsad. I den enda fältstu-
sammanhang där det finns en stor risk för smitta med
dien ingick 21 hästar. Dessa utsattes för smitta i form
Streptococcus equi.
av en häst med diagnostiserad kvarka (Streptococcus
Immunologiska egenskaper
equi). Fjorton av hästarna vaccinerades med två in-
Equilis StrepE är ett levande vaccin. Vaccinstammen
jektioner där den andra gavs tre veckor innan den
är en s.k. deletionsmutant, vilket innebär att den är
smittspridande hästen introducerades. Alla sju kon-
genetiskt modifierad för att ha begränsad möjlighet
troller utvecklade kvarka, i flertalet fall akut med hög
att växa i däggdjursceller. Stammen saknar ett enzym
feber och abcenderade lymfknutor. Av de 14 vaccine-
som behövs för syntes av vissa aromatiska kolfören-
rade hästarna fick tre tydliga kliniska tecken på kvarka
ingar som är essentiella för att bakterietillväxt ska
och ytterligare tre fick sjukdomen i mild form med
kunna ske. Den förökar sig lokalt i slemhinnan under
lindrigt förstorade lymfknutor. Hos de övriga åtta
några dagar men blir snabbt utkonkurrerad av om-
hästarna sågs inga tecken på sjukdomen.
givningsfloran och sprids därför inte i miljön trots att
Säkerhetsvärdering
bakterier urskiljs från vaccinationsstället upp till fyra
Vaccination ger upphov till begränsade kliniska teck-
dagar efter vaccination.
en på infektion. Injektionsstället i läppen svullnar
Hästarna vaccineras genom injektion i läppen. Det
och det kan uppstå en liten varbildning. Reaktionen
visade sig i prekliniska studier att exponering för vac-
uppkommer efter några timmar och är som störst två
cinet på slemhinnan ger otillräckligt skydd och injek-
till tre dagar efter vaccination. Samtidigt kan djuren
tion i muskel ger oacceptabla bieffekter.
få feber och reaktioner i lymfknutorna. Normalt är
Klinisk effekt
vaccinreaktionen helt avläkt inom några veckor. Det
Effekten och effektdurationen av Equilis StrepE un-
finns publicerade uppgifter som visar att kvarka-vac-
dersöktes i ett antal experimentella studier där hästar
ciner i likhet med naturlig infektion i sällsynta fall kan
utsattes för smitta med Streptococcus Equi och upp-
ge upphov till komplikationer i form av purpura hae-
komsten av kliniska tecken i form av feber, näsflöde
morrhagica. Eftersom den kliniska erfarenheten av
och svullna/abcederande lymfknutor bedömdes. Det
Equilis StrepE ännu är begränsad är det inte känt om
visade sig att vaccinet gav ett skydd efter den andra
risken finns även för detta vaccin.
injektionen. Såväl kroppstemperatur som grad av
Litteratur
näsflöde och svullnad i lymfknutorna var signifikant
Av företaget insänd dokumentation. Se även produktinformation
inkluderande en vetenskaplig diskussion på EMEAs hemsida
lägre i den vaccinerade gruppen. Skyddet varade i
(www.emea.eu.int).
tre månader men var otillräckligt hos 25 % av häs-
Information från Läkemedelsverket 5:2005 59
Publicerade monografier 2005
Publicerade monografier 2005
ATC-kod
Publicerat i nr
A
Advocate vet. (imidacloprid, moxidectin)
QP54AB52
2005:4
Alimta
(pemetrexed)
L01BA04
2005:4
Avastin
(bevacizumab)
L01XC07
2005:3
B
Boviseal vet.
(tungt vismutsubnitrat)
QG52X
2005:1
C
Cymbalta
(duloxetin)
N06AX21
2005:4
D
Diovan
(valsartan)
C09CA03
2005:2
E
Enbrel
(etanercept)
L04AA11
2005:4
G
Gastrogard vet. (omeprazol)
QA02BC01
2005:1
Gemzar
(gemcitabin)
L01BC05
2005:2
I
Inspra
(eplerenon)
C03DA04
2005:1
L
Lyrica
(pregabalin)
N03
2005:2
M
Milbemax vet. (milbemycin och praziquantel) QP52AD, QP52AA
2005:1
Mimpara
(cinacalcet hydroklorid)
H05BX01
2005:1
N
Niaspan
(nikotinsyra)
C01AD02
2005:2
P
Pedea
(ibuprofen)
C01EB16
2005:1
Propaline vet. (fenylpropanolamin)
QG04BX91
2005:3
Protelos
(strontiumranelat)
M05BX03
2005:1
R
Raptiva
(efalizumab)
L04AA21
2005:4
S
Stronghold vet. (selamektin)
QP54AA05
2005:4
T
Tiamutin vet. (tiamulin)
QJ01XX92
2005:1
V
Vesicare
(solifenacin succinate)
G04BD08
2005:2
60 Information från Läkemedelsverket 5:2005
 Läkemedelsförmånsnämnden
Läkemedelsförmånsnämnden, LFN, är den myndighet som beslutar vilka läkemedel och förbrukningsartiklar som
ska subventioneras av samhället. Besluten fattas av en nämnd som finns inom myndigheten. Nämnden består av
en ordförande och tio ledamöter. Ledamöterna har tillsammans en bred medicinsk, såväl praktisk som vetenskaplig,
och hälsoekonomisk kompetens. Två av ledamöterna har erfarenhet från brukargrupper.
Fortsatt granskning av blodtrycksläkemedel
Läkemedelsförmånsnämnden
Läkemedelsförmånsnämnden, LFN, är den myndighet som beslutar vilka läkemedel och förbrukningsartiklar som
ska subventioneras av samhället. Besluten fattas av en nämnd som finns inom myndigheten. Nämnden består av
en ordförande och tio ledamöter. Ledamöterna har tillsammans en bred medicinsk, såväl praktisk som vetenskaplig,
och hälsoekonomisk kompetens. Två av ledamöterna har erfarenhet från brukargrupper.
Fortsatt granskning av blodtrycksläkemedel
I genomgången av läkemedelssortimentet har LFN
varande kunskapsläget om den aktuella läkemedels-
beslutat att fortsätta granskningen av läkemedel mot
gruppen. Om vi anser att kartläggningsfasen ger till-
högt blodtryck. I gruppen kommer läkemedlen att delas
räcklig information för att samtliga läkemedel i den
in i fem undergrupper.
granskade gruppen även fortsättningsvis bör subven-
I genomgången av läkemedel mot högt blodtryck
tioneras så avslutar vi genomgången.
går nu granskningen vidare i den andra delen som vi
Om nämnden däremot finner att det råder osä-
kallar beslutsfasen. Själva kartläggningsfasen är i och
kerhet kring något, några eller hela gruppen av läke-
med det avslutad. Den fortsatta granskningen om-
medel går genomgången vidare i en beslutsfas. För
fattar samtliga läkemedel i gruppen. Vi har då valt
läkemedel mot högt blodtryck går vi alltså vidare till
att dela in läkemedlen i fem undergrupper baserat på
denna fas. Det innebär att vi gör en mer omfattande
läkemedlens så kallade ATC-kod (läkemedelsklass).
utredning och analys, som sedan leder till beslut om
Startordningen för beslutsfasen styrs av den totala
de enskilda läkemedlen ska behålla sin subvention el-
försäljningen i respektive undergrupp. Arbetet med
ler inte.
de fem grupperna kommer att löpa parallellt och av-
Startskottet för genomgången av läkemedelssorti-
slutas vid samma tillfälle. Däremot kan alltså startid-
mentet gick i slutet av år 2003. LFN ska pröva sub-
punkten för arbetet med respektive grupp i nästa fas
vention för cirka 2 000 läkemedel enligt de nya sub-
vara olika.
ventionsreglerna som trädde i kraft 2002.
Genomgången av en läkemedelsgrupp kan delas in
Mer om genomgången av läkemedelssortimentet
i två faser: en kartläggnings- och en beslutsfas. Syftet
hittar du på www.lfn.se.
med kartläggningsfasen är att sammanfatta det nu-
LFN beviljar subvention för Ritalin
LFN beslutar att läkemedlet Ritalin ska ingå i förmå-
Läkemedelskostnaden för Ritalin i tablettform är läg-
nerna. Ritalin används vid behandling av ADHD och
re än kostnaden för depåkapseln och för Concerta.
innehåller samma aktiva substans som Concerta, som
Trots att det uppkommer andra kostnader på grund
sedan tidigare ingår i läkemedelsförmånerna.
av att tabletten måste tas flera gånger per dag, fyller
den behov som inte kan tillgodoses med de andra al-
LFN anser att det vid läkemedelsbehandling av
ternativen. Det handlar framför allt om inställning av
ADHD behövs produkter som medger både enkel
dos och behandling av barn med behov av en låg dos.
underhållsbehandling och som gör det möjligt att
LFN bedömer att behandling med Ritalin i tablett-
ställa in dos och modifiera behandlingen.
form är rimligt kostnadseffektiv vid sådan använd-
Företaget har ansökt om två olika beredningsfor-
ning, eftersom det saknas någon annan jämförbar
mer av läkemedlet, Ritalin tablett respektive Ritalin
produkt för dessa behov.
depåkapsel. Prisjämförelser baserade på klinisk ef-
På www.lfn.se kan du läsa mer om beslutet om Ritalin.
fekt och genomsnittlig kostnad per milligram visar
att kostnaden för behandling med Ritalin depåkapsel
inte blir högre än med Concerta.
För dessa sidor ansvarar LFN:
Läkemedelsförmånsnämnden, kontakt: Fredrik Larsson, Box 55, 171 11 Solna,
Telefon: +46 8 56 84 20 68, e-post: xxxxxxx.xxxxxxx@xxx.xx, www.lfn.se
Information från Läkemedelsverket 5:2005 61

Läkemedelsförmånsnämnden informerar
LFN beviljar ansökan för Emselex
LFN beslutar att läkemedlet Emselex ska ingå i förmå-
månerna, eftersom den är billigare än övriga produk-
nerna. Läkemedlet används vid behandling av över-
ter och är ett lämpligt alternativ för de patienter som
aktiv blåsa och är billigare än de närmast jämförbara
behöver en högre dos av läkemedlet.
produkterna.
LFN har valt att inte tidsbegränsa subventionen,
trots att dokumentationen kring Emselex effekt i
De studier som gjorts visar att Emselex har ungefär
vardaglig användning är svag. Detta beror på att vi
samma effekt som de två närmast jämförbara läke-
redan under hösten 2006 kommer att inleda genom-
medlen som används vid behandling av överaktiv
gången av den grupp där bland annat läkemedel som
blåsa. Priset för Emselex är dock lägre än priset på
används vid överaktiv blåsa ingår. En tidsbegränsning
alla styrkor av dessa produkter.
som sträcker sig över den perioden skulle försvåra
Företaget har ansökt om subvention för två styr-
detta arbete. Genomgången kommer att ge en bättre
kor av Emselex, nämligen 7,5 och 15 mg. Den lägre
möjlighet att utvärdera kostnadseffektiviteten för lä-
styrkan kan anses vara kostnadseffektiv, det vill säga
kemedel mot överaktiv blåsa, både som grupp och
att den ger tillräckligt mycket nytta i förhållande till
som enskilda produkter.
vad den kostar. Det är mer tveksamt om den högre
På www.lfn.se kan du läsa hela beslutet om Emselex.
styrkan också är kostnadseffektiv, eftersom den tycks
ge fler biverkningar. Denna styrka bör ändå ingå i för-
Begränsad subvention för Elidel
LFN beslutar att eksemläkemedlet Elidel ska ingå i för-
Det finns dock osäkerhet i de kliniska data som finns
månerna med vissa begränsningar. Begränsningarna
om läkemedlet och kring hur Elidel kommer att an-
innebär att Elidel blir subventionerat för behandling
vändas i klinisk vardag. Därför kommer Elidel endast
av milt till måttligt svårt atopiskt eksem i ansiktet och
att ingå i förmånerna till och med den 31 decem-
på halsen hos patienter där behandling med lokala glu-
ber 2007. Företaget har möjlighet att innan tids-
kokortikoider prövats och funnits olämplig, samt för
begränsningen går ut, lämna in en ny ansökan med
patienter som är allergiska mot lokala glukokortikoi-
dokumentation som tydligare visar hur läkemedlet
der.
används och dess effekt. Dessutom ska företaget i all
sin marknadsföring tydligt informera om att Elidel
Företaget har för andra gången ansökt om subven-
endast är subventionerat med begränsning.
tion för Elidel. Den första ansökan avslogs av nämn-
den i maj 2004. Anledningen var då bland annat att
Begränsning av subvention för Elidel
nämnden inte ansåg att företaget i sin hälsoekono-
Elidel 1 % kräm ingår i läkemedelsförmånerna för be-
miska analys visat att Elidel var kostnadseffektivt för
handling av milt till måttligt svårt atopiskt eksem i
den patientgrupp man ansökte om subvention för.
ansikte och på hals hos patienter där behandling med
Läkemedelsverket har sedan dess gett ut nya be-
lokala glukokortikoider prövats och befunnits vara
handlingsrekommendationer. LFN utgår från att
olämplig samt för patienter som är allergiska mot lo-
dessa leder till att användningen av Elidel vid milt
kala glukokortikoider.
atopiskt eksem blir mindre än vad nämnden antog i
På www.lfn.se hittar du hela beslutet om Elidel.
sitt förra beslut. Tillsammans med annan nytillkom-
men information kan Elidel nu antas vara kostnads-
effektivt för den patientgrupp som saknar alternativ
behandling.
För dessa sidor ansvarar LFN:
Läkemedelsförmånsnämnden, kontakt: Fredrik Larsson, Box 55, 171 11 Solna,
Telefon: +46 8 56 84 20 68, e-post: xxxxxxx.xxxxxxx@xxx.xx, www.lfn.se
62 Information från Läkemedelsverket 5:2005

Läkemedelsförmånsnämnden informerar
Snabbare nyheter med LFN:s nyhetstjänst
Nu kan du som skriver ut läkemedel få nyheter från
Du kommer aldrig att få mer än ett mejl per dag, oav-
LFN samma dag som de läggs ut på hemsidan. Med
sett hur många kategorier du prenumererar på. Hem-
LFN:s nyhetstjänst kan du välja att få nyheter inom
sidan ”läses av” varje kväll och därefter sammanställs
det eller de områden som intresserar just dig.
ett mejlutskick som går ut till alla prenumeranter på
samma gång.
Med vår nyhetstjänst får du nyheter om beslut om
Du kan självfallet fortfarande prenumerera på vårt
subvention av ett läkemedel eller andra nyheter inom
nyhetsbrev. Detta ger i artikelform en sammanfatt-
enskilda terapiområden. Du kan välja att få nyheter
ning av våra viktigaste beslut och nyheter och kom-
inom elva olika kategorier och du har själv möjlig-
mer ut vid behov eller minst tio gånger per år.
het att välja det eller de områden som intresserar just
Besök vår hemsida www.lfn.se för att starta en pre-
dig.
numeration!
Snabbguide till LFN:s beslut
Beviljas generell subvention
Eligard – Läkemedlet används vid behandling av
Targretin – Targretin används för att behandla
prostatacancer.
cancerformen CTCL (kutan T-cellslymfom).
Emselex – Läkemedel som används vid behand-
Telzir – Telzir används för behandling av hiv.
ling av överaktiv blåsa och är billigare än de närmast
Tobrex Depot – Läkemedlet behandlar ytliga bak-
jämförbara produkterna.
teriella infektioner i ögat. Det är en depåberedning
Kentera – Kentera är ett depotplåster, som an-
av Tobrex som sedan tidigare finns i läkemedelsför-
vänds när någon lider av trängningsinkontinens
månerna.
och/eller kissar väldigt ofta (täta miktioner) samt
Beviljas begränsad subvention
mot trängningar utan läckage som kan uppstå hos
patienter med instabil blåsa.
Elidel – Eksemläkemedel som subventioneras för
Kivexa – Läkemedel som används för behandling
behandling av milt till måttligt svårt atopiskt eksem i
av hiv.
ansiktet och på halsen hos patienter där behandling
Nebido – Nebido är en ersättning som används
med lokala glukokortikoider (en annan läkemedels-
för att kompensera när produktionen hos män av
grupp som används vid behandling av atopiskt ek-
könshormonet testosteron inte räcker till.
sem) prövats och funnits olämplig, samt för patienter
Selsun – Läkemedlet är godkänt för behandling
som är allergiska mot lokala glukokortikoider. Sub-
av olika typer av mjällbildning: vanligt mjäll, sebor-
ventionen är tidsbegränsad till och med den 31 de-
ré (som beror på en onormalt ökad talgutsöndring)
cember 2007.
samt pityriasis versicolor. Det sista är en hudsjukdom
Protelos – Läkemedel mot benskörhet. Subven-
med mjällik fjällning som orsakas av en ganska vanlig
tioneras bara för kvinnor som passerat klimakteriet
svampinfektion som ger brunaktiga, bortskrapbara
och som inte kan behandlas med vanliga benskör-
fläckar.
hetsläkemedel eller som är 74 år eller äldre. Protelos
Ritalin – Ritalin används vid behandling av ADHD
är av Läkemedelsverket godkänt för behandling som
och innehåller samma aktiva substans som Concerta,
ska minska risken för kot- och höftfrakturer hos ben-
som sedan tidigare ingår i läkemedelsförmånerna.
sköra kvinnor som passerat klimakteriet (postmeno-
pausala).
De nya läkemedelsförmånerna
Avslag på subvention
– ett produktinriktat system med två
Periochip – Företaget har inte lämnat in någon
subventionsmöjligheter.
dokumentation som styrker att Periochip har bättre
klinisk effekt än konkurrerande, billigare produkter.
• Generell subvention innebär att ett lä kemedel
Periochip används tillsammans med mekanisk rengö-
är subventionerat för hela det godkända
ring som antibakteriell behandling av tandköttsfickor
användningsområdet.
hos vuxna med måttlig till svår kronisk tandköttsin-
• Begränsad subvention innebär att ett läke-
flammation (parodontit).
medel bara är subventionerat för ett visst
användningsområde.
För dessa sidor ansvarar LFN:
Läkemedelsförmånsnämnden, kontakt: Fredrik Larsson, Box 55, 171 11 Solna,
Telefon: +46 8 56 84 20 68, e-post: xxxxxxx.xxxxxxx@xxx.xx, www.lfn.se
Information från Läkemedelsverket 5:2005 63
Posttidning
B
LÄKEMEDELSVERKET
BOX 26
Rapportering av läkemedelsbiverkningar hos människa
751 03 UPPSALA
Läkemedel för vilka alla misstänkta biverkningar skall rapporteras
Godkända 2002*
som inte står upptagna som ”vanliga” i FASS
Preparat
Substans
Kivexa
Abacavir+lamivudin
Levemir
Insulin detemir
Arcoxia
Etoricoxib
Lipoplus
Lösning för parenteral nutrition
Arixtra
Fondaparinux
Lyrica
Pregabalin
Concerta
Metylfenidat
Lysodren
Mitotan
Copegus
Ribavirin
Melagatran AstraZeneca
Melagatran
Dynastat
Parecoxib
Menopur
Menotropin
Ebixa
Memantin
Mimpara/Parareg
Cinacalcet
Evra
Norelgestromin + etinylöstradiol
Mucoangin
Ambroxol
Lumigan
Bimatoprost
Multibic
Hemofiltrationsvätska
Protopic
Takrolimus
Myfortic
Mykofenolsyra
Somavert
Pegvisomant
Nebido
Testosteron
Tamiflu
Oseltamivir
Niaspan
Nikotinsyra
Tracleer
Bosentan
Novastan
Argatroban
Xigris
Rekombinant humant aktiverat protein C
Olux
Klobetasol
Godkända 2003
Ocplex
Antihemofilifaktorer B (faktor IX)
Preparat
Substans
Osseor/Protelos
Strontiumranelat
Aldurazyme
Laronidas
Pedea
Ibuprofen
Allurene/Angeliq
Drospirenon + östradiol
PhotoBarrr
Porfimernatrium
Avandamet
Metformin + rosiglitazon
Physioneal 35/40 Glucose Clear-Flex Hyperton lösning
Bextra/Kudeq/Valdyn
Valdecoxib
Primograf/Primovist
Paramagnetiskt kontrastmedel
Carbaglu
Karglutamsyra
Rabipur
Vaccin mot rabies
Cerezyme
Imiglukeras (ny indikation)
Raptiva
Efalizumab
Certican/Everolimus Novartis
Everolimus
Reyataz
Atazanavir
Duraphat
Natriumfluorid
Salofalk
Mesalazin
Crestor/Visacor
Rosuvastatin
SMOFlipid
Fettemulsion
Elidel
Pimekrolimus
Tachosil
Fibrinogen, trombin
Emtriva
Emtricitabin
Telzir
Fosamprenavirkalcium
Ezetrol/Ezetimibe MSD-SP
Ezetimib
Testim
Testosteron
Forsteo
Teriparatid
Teveten Comp
Eprosartan+hydroklortiazid
Fuzeon
Enfuviritid
Tostrex
Testosteron
Glucosine
Glukosamin
Varivax
Vaccin mot varicella
Gynol-Plus
Nonoxinol
Velcade
Bortezomib
Healip
Docosanol
Vesicare
Solifenacin
Hepsera
Adefovir dipivoxil
ViATIM
Vaccin mot tyfus-hepatit A
Humira/Trudexa
Adalimumab
Wilzin
Zinkacetat
Levitra/Vivanza
Vardenafil
Viroflu
Vaccin mot influensa
Rescula
Unoproston
Xagrid
Anagrelid
Theryttrex
Yttrium
Xeristar
Duloxetin
Ventavis
Iloprost
Xyzal
Levocetirizin
Vistabel
Botulinum toxin
Zevalin
Monoklonala antikroppar
Xepol
Humant immunoglobulin
Godkända till och med 1 mars 2005
Ytracis
Yttrium
Preparat
Substans
Zaxem
Butenafin
Alvesco/Amavio/Freathe
Ciklesonid
Godkända 2004
Avastin
Bevacizumab
Preparat
Substans
Azilect
Rasagilin
Abilify
Aripiprazol
Bifril Comp/
Hydroklortiazid + zofenopril
Advate
Octocog alfa
Zofenil Comp
Alimta
Pemetrexed
Fendrix
Vaccin mot hepatit B
Angiox
Bivalirudin
Inegy/Vytorin
Ezetimib + simvastatin
Apidra
Insulin glulisin
Litiumklorid Lidico
Litiumklorid
Ariclaim/Yentreve
Duloxetin
Orfadin
Nitisinon
BCG-vaccin SSI
Vaccin mot tuberkulos
Prialt
Ziconotid
Bonviva/Ibandronic acid Roche
Ibandronat
Quintanrix
Vaccin mot difteri, kikhosta,
Boostrix Polio
Vaccin mot difteri-hepatit B-tetanus
hepatit B, stelkramp
Colosol
Makrogol, kombinationer
Striant
Testosteron
Corvital
Vitaminer, kombinationer
Truvada
Emtricitabin + tenofovir
Cymbalta
Duloxetin
Docenz/Afluria
Vaccin mot influensa
Dukoral
Vaccin mot kolera
OBS! Alla preparat marknadsförs inte i Sverige.
Duodopa/DopaJel
Levodopa + karbidopa
Hur rapporterar man?
Emselex
Darifenacin
Erbitux
Cetuximab
Rapportering till Läkemedelsverket bör ske på särskild blankett.
Estrofem
Östradiol
Enklast kan rapportering ske genom att:
Exarta
Ximelagatran
• blanketthuvudet på blanketten ifylles
Faslodex
Fulvestrant
• biverkningens art (diagnos) ifylles
Flector
Diklofenak
• kopia medsändes på epikris + annan relevant information.
Forlax
Makrogol (Ny indik: Barn fr 8 år)
Fosrenol
Lantankarbonat
Adresskällor: LV:s adressregister samt
FSME-IMMUN
Vaccin mot fästingburen encefalit
Cegedim AB
Gelofusine
Gelatinpeptid-polymeriserat
Glucophage/Metformin Merck
Metformin (Ny indik: Barn fr 10 år)
HAR DU ÄNDRAT ADRESS?
HeliCap
Urea (14C)
Är adressen fel ber vi dig klippa ur etiketten med den
Hexvix
Hexaminolevulinat
gamla adressen och skicka den tillsammans med din
Hydrokortison Nycomed
Hydrokortison
Inspra
Eplerenon
nya adress till Läkemedelsverket, Informationsskrif-
Invivac
Vaccin mot influensa
ten, Box 26, 751 03 Uppsala
Kentera
Oxybutynin
64 Information från Läkemedelsverket 5:2005
















